Resultados muestran la influencia de factores abióticos y bióticos

Entre las enfermedades infecciosas de camarones peneidos, el síndrome de la mancha blanca (WSS) y la enfermedad de necrosis hepatopancreática aguda (AHPND – anteriormente conocida como “síndrome de mortalidad temprana” o EMS) – son actualmente las amenazas más graves para los productores camaroneros. El WSS es causado por el virus del síndrome de la mancha blanca (WSSV), mientras que el AHPND es una bacteriosis emergente causada por cepas virulentas de Vibrio parahaemolyticus y V. harveyi. La adopción de prácticas de bioseguridad en las granjas es necesaria para limitar la entrada de patógenos en los sistemas de cultivo.
Entre las prácticas de bioseguridad en las granjas camaroneras, la tecnología superintensiva (BFT) de biofloc es un prometedor sistema de cultivo alternativo. Se cree ampliamente que el cultivo de BFT mejora la inmunidad de los crustáceos, lo que conduce a altas tasas de supervivencia, incluso bajo infecciones bacterianas y virales. Aunque todavía no se conocen los mecanismos subyacentes a la robustez del camarón, se espera una condición de inmunoestimulación contínua considerando la abundancia de patrones moleculares asociados a microbios (MAMP) presentes en los sistemas BFT que pueden activar respuestas inmunes innatas.
Debido a que el ambiente acuático puede influir en la composición y abundancia de la microbiota, se requieren estudios que centren la contribución de BFT en el establecimiento de la microbiota intestinal del camarón. Además, ahora está bien establecido que la microbiota comensal es esencial para la correcta funcionalidad de la fisiología del huésped. Sorprendentemente, la caracterización de las comunidades microbianas presentes en el tracto digestivo de las especies de camarones cultivadas se ha descubierto recientemente.
Hasta donde sabemos, solo un informe sobre la descripción de las comunidades bacterianas intestinales de una especie de peneidos – el camarón azul del Pacífico (Litopenaeus stylirostris) – cultivado en un sistema BFT está disponible en la literatura. Además, no se sabe nada acerca de la plasticidad del bacterioma (un órgano especializado con células especializadas que proporciona refugio y nutrientes a las bacterias mientras protege al animal huésped) en los camarones infectados por el WSSV, uno de los patógenos más importantes en el cultivo de camarones.
Este artículo, adaptado y resumido de la publicación original, fue diseñado para caracterizar la abundancia y composición de las comunidades bacterianas intestinales de las especies de peneidos más importantes, el camarón blanco del Pacífico (L. vannamei) criado en BFT y un sistema de agua de mar clara. Asimismo, se investigó la plasticidad del bacterioma del intestino medio del camarón desafiado por WSSV. Nuestros resultados aportan nuevas pruebas de la influencia del cultivo de biofloc y el desafío viral en el bacterioma del camarón, proporcionando nuevas ideas sobre futuros estudios sobre el papel de la microbiota en la inmunidad intestinal del camarón peneido cultivado.
Configuración del estudio
Postlarvas de L. vannamei (de cinco días, PL5) de un criadero comercial de camarones (Aquatec LTDA Canguaratema, Rio Grande do Norte, Brasil) se utilizaron en este estudio en el Laboratorio de Camarones Marinos (Universidad Federal de Santa Catarina, Florianópolis, Brasil) . El cultivo de biofloc se estableció inicialmente en un tanque de matriz de 50 metros cúbicos y el diseño experimental se muestra en la Figura 1.
Las PLs se sembraron aleatoriamente en ocho tanques bajo techo de 9 metros cúbicos, con cuatro tanques de BFT y cuatro tanques de sistema de agua de mar transparente, con una densidad de población inicial de 300 y 20 PL5 por metro cúbico, respectivamente. Los tanques se airearon continuamente (oxígeno disuelto > 5 mg / L) y se mantuvieron a temperatura controlada (29 ± 1 grados-C) y salinidad (34 a 35 ppt).
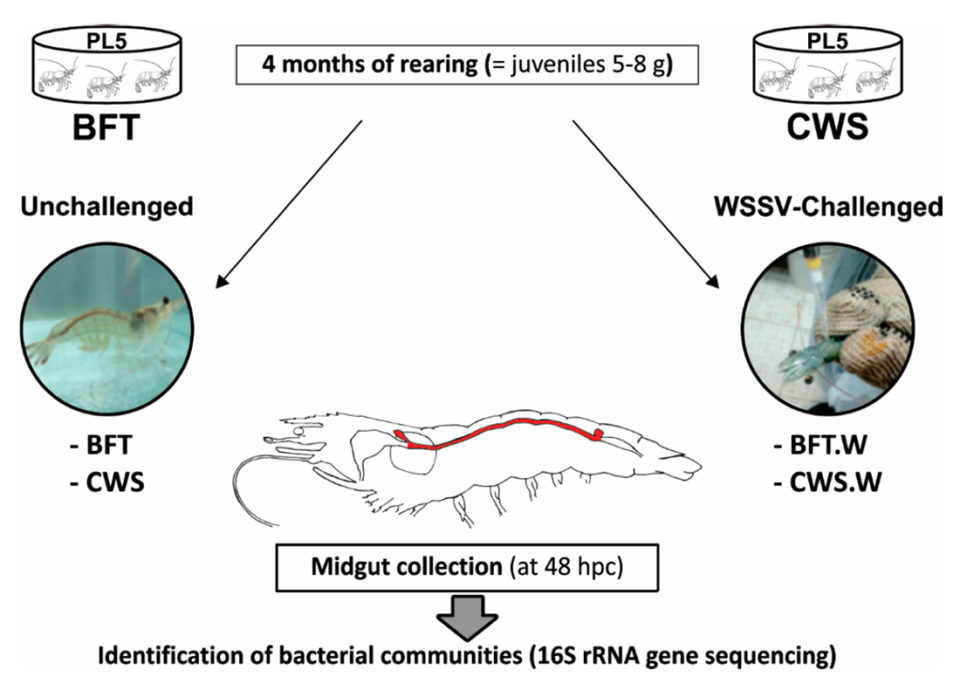
Los camarones fueron alimentados cuatro veces al día con una dieta comercial (Guabi Potimar), y el agua de los tanques se recambio al 80 por ciento diario. Después de cuatro meses, cuando los camarones se habían convertido en juveniles de 5 a 8 gramos, alrededor del 30 por ciento de los animales de cada tanque / grupo fueron seleccionados al azar para confirmar que los camarones estaban libres de WSSV mediante el uso de la prueba de PCR anidada, y luego se transfirieron 120 animales de cada sistema de cultivo al Laboratorio de Inmunología Aplicada a la Acuicultura (Universidad Federal de Santa Catarina, Florianópolis, Brasil) para diversas pruebas y análisis.
Para una descripción detallada del diseño experimental; WSSV per os (oral) desafío y recolección de intestino medio; extracción de ADN genómico (ADNg); Preparación de la biblioteca de genes 16S rARN y secuenciación de alto rendimiento; y análisis de datos de secuencia, consulte la publicación original.
Resultados y discusión
Nuestro estudio exploró la dinámica de las comunidades bacterianas (abundancia y composición filogenética) en el intestino medio del camarón en respuesta a dos factores abióticos y bióticos importantes relacionados con la cría de camarones (sistema de cultivo e infección viral) mediante la evaluación de la secuenciación del gen 16S rARN [esta técnica se utiliza reconstruyendo filogenias – historias evolutivas – debido a las lentas tasas de evolución de esta región del gen]. Generamos dos bibliotecas de genes 16S ARNr bacterianos a partir de los tractos intestinales medianos de camarones cultivados en una tecnología BioFloc (biblioteca “BFT”) y en un sistema de agua de mar transparente (biblioteca “CWS”). Del mismo modo, se generaron otras dos bibliotecas a partir del intestino medio de los camarones desafiados con el WSSV utilizando un método per os (bibliotecas “BFT.W” y “CWS.W”).
El análisis de los diagramas de Venn [que muestran todas las relaciones lógicas posibles entre una colección finita de diferentes conjuntos] reveló diferencias significativas en la distribución de frecuencias de las unidades taxonómicas operativas bacterianas (OTU; definición operativa utilizada para clasificar grupos de individuos estrechamente relacionados) de acuerdo con el sistema de cultivo (BFT y CWS) y desafío viral (Fig. 2). El intestino medio de los animales cultivados en BFT exhibió un mayor número de OTU en comparación con los de CWS. Quinientos setenta y un OTU se encontraron exclusivamente en camarones criados en bioflocs (361 en BFT, 111 en BFT.W y 99 en ambos grupos), mientras que 298 OTU eran exclusivos de camarones criados en agua de mar clara (162 en CWS, 121 en CWS.W y 15 en ambas condiciones).
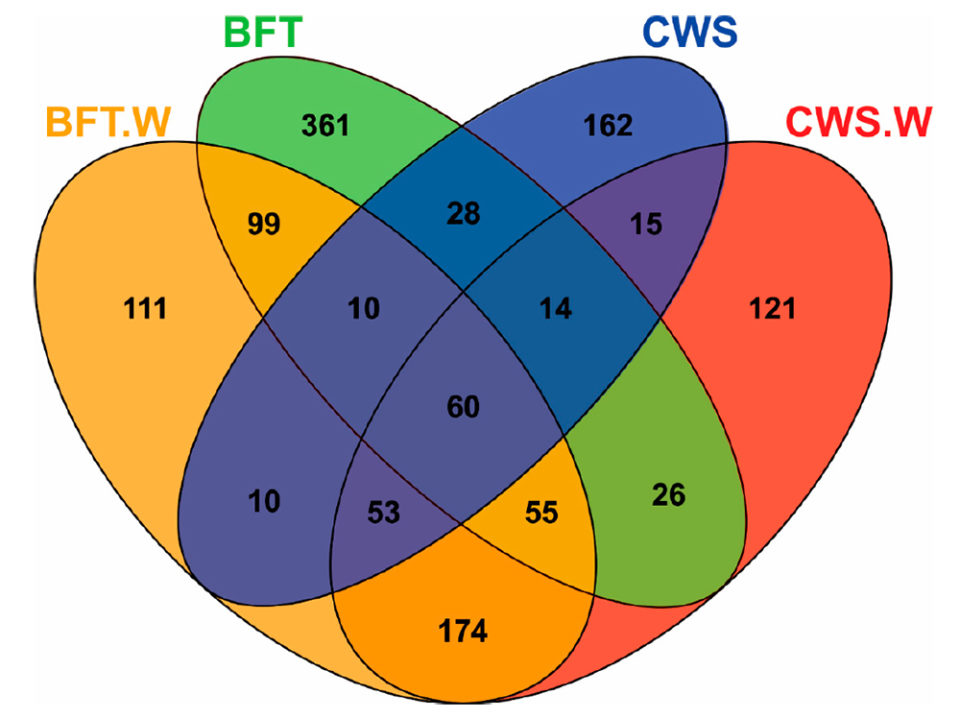
El mayor número de OTU exclusivas de las muestras de BFT podría reflejar la diversidad de microbiomas del entorno biofloc. El desafío viral llevó a la aparición de OTU exclusivas en cada condición de cría: 111 OTU para BFT.W y 121 para CWS.W. Además, las OTU exclusivas (n = 174) fueron compartidas solo por los animales desafiados en ambas condiciones de cría. Estos hallazgos sugieren que este desplazamiento de la comunidad bacteriana en el intestino medio está relacionado con la presencia del virus. Finalmente, se compartieron 60 OTU entre todas las muestras, lo que representó el 4.61 por ciento del total de las OTU. Este subconjunto de bacterias presente en todos los grupos podría representar microorganismos relevantes para la estructura y función fundamental de la microbiota intestinal del camarón. Estudios adicionales sobre la interacción microbiota camarones-virus relacionados con el sistema de crianza BFT merecen ser llevados a cabo en el futuro.
Con respecto a la influencia de las condiciones de cría en las comunidades bacterianas del intestino medio del camarón, se cree ampliamente que la composición de microbiota comensal en artrópodos adultos [animales invertebrados con un exoesqueleto (esqueleto externo), como insectos y crustáceos] parece estar íntimamente relacionada con la inicial exposición a microorganismos durante su vida temprana. Por lo tanto, cultivamos nuestros camarones en BFT y CWS durante cuatro meses (PL5 a 5 a 8 gramos) antes de las pruebas de laboratorio. En nuestro análisis, las secuencias del gen 16S rRNA de alta calidad resultantes se clasificaron en 33 filamentos procariotas que pertenecen al dominio Bacteria. Los filamentos más representativos identificados en el intestino medio de L. vannamei fueron Proteobacterias, Bacteroidetes, Actinobacterias y Firmicutes. Sin embargo, la distribución de frecuencia de las comunidades bacterianas intestinales difería según el sistema de cría (Fig. 3).
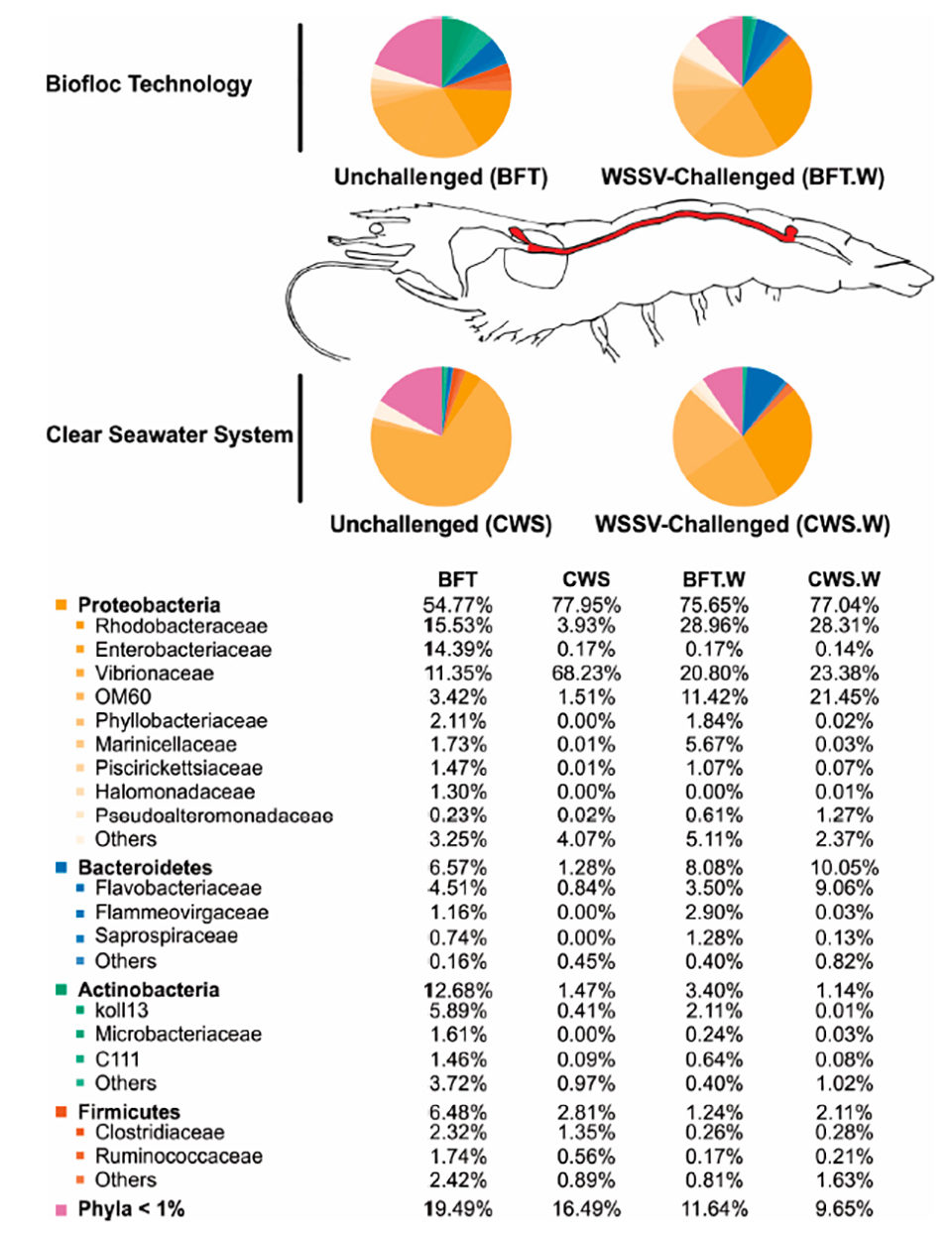
El género Vibrio está compuesto por bacterias acuáticas de rápido crecimiento capaces de colonizar el tracto digestivo de diferentes animales, incluidos los camarones peneidos. Muchas especies de Vibrio son patógenos oportunistas en los camarones en condiciones estresantes – como una mala nutrición, baja calidad del agua y depresión inmunológica. En camarones cultivados, este grupo bacteriano ha sido implicado repetidamente en enfermedades gastrointestinales, lo que lleva a una alta mortalidad de camarones. Los microorganismos presentes en el agua BFT podrían actuar contra las bacterias patógenas al competir por el sustrato y los nutrientes, produciendo compuestos inhibidores e interfiriendo en la detección de la comunicación de quórum bacteriano [un sistema de estímulos y respuesta correlacionados con la densidad de la población, utilizados por muchas bacterias para coordinar la expresión génica de acuerdo con a la densidad de su población local].
Curiosamente, dos familias de Proteobacterias – Rhodobacteraceae y Enterobacteriaceae – fueron más abundantes en el intestino medio de los camarones criados en BFT que en CWS, lo que representa alrededor del 15 por ciento en BFT y menos del 4 por ciento en CWS. El papel de esta familia bacteriana en la microbiota intestinal del camarón no se conoce bien, pero se cree que el sistema BFT puede favorecer la presencia de esta familia de bacterias debido a su alta concentración de sólidos en suspensión que pueden ser utilizados como sitios de crecimiento por Rhodobacteraceae. Los miembros de la familia pueden establecer una actividad antagónica que limita la supervivencia del Vibrio patógeno. Por lo tanto, podríamos plantear la hipótesis de que la mayor abundancia de Rhodobacteraceae en el intestino medio de L. vannamei criado en BFT podría estar asociada con una menor abundancia de Vibrionaceae.
Nuestros hallazgos indican que el bacterioma del camarón criado en BFT era más diversificado y rico en comparación con el de los animales criados en agua de mar clara, donde la comunidad bacteriana predominante era Vibrionaceae. El agua de BFT es especialmente rica en materia orgánica y partículas suspendidas, lo que puede favorecer a las bacterias que utilizan materia orgánica y compuestos de nitrógeno para el crecimiento. Además, el sistema de cría de BFT aparentemente causa modificaciones importantes en la microbiota del intestino medio del camarón en comparación con CWS, lo que corrobora el hecho de que la microbiota del tracto digestivo de los animales acuáticos está directamente influenciada por el medio ambiente. Además, la idea de considerar el BFT como un “sistema probiótico natural” tiene importantes consecuencias para la microbiota intestinal. El BFT podría actuar internamente y / o externamente al cuerpo del camarón, un efecto promovido por grandes grupos de microorganismos, pero principalmente bacterias.
Con respecto a los efectos beneficiosos del sistema BFT, los bioflocs pueden actuar como inmunoestimulantes y mejorar el sistema inmune innato del camarón, incluso alterando la expresión de genes relacionados con la respuesta inmune del camarón, lo que podría atribuirse a la capacidad del BFT para inducir cambios en la microbiota del camarón. En general, nuestros resultados muestran que la microbiota intestinal del camarón se ve alterada por el entorno de cultivo.
Con respecto a la plasticidad de la microbiota intestinal del camarón en respuesta a un desafío viral, los resultados más impactantes de nuestro estudio fueron el caracterizar el cambio de las comunidades bacterianas en el intestino medio del camarón desafiado por WSSV. Hasta donde sabemos, solo hay un estudio sobre el cambio de la microbiota intestinal en respuesta a la infección por WSSV, evaluado en el cangrejo chino. El nuestro es el primer estudio que investiga el efecto de un patógeno viral en la microbiota intestinal de una especie peneida criada en un sistema BFT.
Perspectivas
Mediante el uso de una tecnología de secuenciación de alto rendimiento, hemos caracterizado el bacterioma intestinal de las especies de camarones cultivadas más importantes, L. vannamei, y evaluamos la influencia de la cría de BFT y del desafío del WSSV en la composición y abundancia de las comunidades bacterianas.
La composición bacteriana del intestino medio de los camarones criados en bioflocs era más rica y diversa que la del agua de mar clara. El grupo bacteriano predominante pertenecía al filo Proteobacteria (Rhodobacteraceae, Enterobacteriaceae y Vibrionacea), seguido del phylum Bacteroidetes (Flavobacteriaceae), Actinobacteria y Firmicutes. Vibrionaceae fue más abundante en el grupo CWS que en los camarones criados con BFT (68.23 por ciento y 11.35 por ciento de las comunidades bacterianas totales, respectivamente).
La composición bacteriana del intestino medio de L. vannamei se vio afectada por el desafío WSSV. Vibrionaceae fue la familia bacteriana más afectada y su abundancia se duplicó en el intestino medio de los camarones criados con BFT después del desafío viral, mientras que en los camarones criados con CWS disminuyó drásticamente. Además, el desafío WSSV aparentemente condujo a una distribución más homogénea de la composición de la población bacteriana, como Rhodobacteraceae, Enterobacteraceae y Vibrionaceae, en el intestino medio de los camarones criados en ambos sistemas de cultivo, BFT y CWS. Los cambios en la diversidad de bacterias intestinales asociadas al desafío WSSV.
La composición bacteriana del intestino medio de L. vannamei se vio afectada por el desafío WSSV. Vibrionaceae fue la familia bacteriana más afectada y su abundancia se duplicó en el intestino medio de los camarones criados con BFT después del desafío viral, mientras que disminuyó drásticamente en los camarones criados en CWS. Además, el desafío WSSV aparentemente condujo a una distribución más homogénea de la composición de la población bacteriana – como Rhodobacteraceae, Enterobacteraceae y Vibrionaceae – en el intestino medio de los camarones criados en ambos sistemas de cultivo, BFT y CWS. Los cambios en la diversidad de bacterias intestinales asociados con el desafío WSSV podrían indicar un desplazamiento en las comunidades microbianas intestinales que conducen a la disbiosis (un desequilibrio microbiano o mala adaptación en o dentro del cuerpo, como una microbiota deteriorada).
Conocer las poblaciones bacterianas intestinales de camarones criados en BFT y durante la infección por WSSV es un paso relevante para comprender el papel de la microbiota bacterioma intestinal en las defensas inmunes de los crustáceos contra enfermedades virales. Aunque los mecanismos moleculares involucrados en el control y la regulación de la microbiota intestinal del camarón aún se desconocen en gran medida, las condiciones ambientales y la presencia de agentes infecciosos demostraron ser factores decisivos que influyen tanto en la diversidad como en la abundancia de las comunidades bacterianas.
Con estos datos de secuenciación de 16S ARNr disponibles, y dado que el camarón peneido es un modelo excelente para estudios genómicos funcionales, ahora podemos investigar el camarón en las interacciones huésped-microbiota, y también el papel de la microbiota comensal en la regulación de la inmunidad intestinal del camarón.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (la Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $ 50 al año.
Authors
-
Dr. Mariana R. Pilotto
Laboratory of Immunology Applied to Aquaculture
Department of Cell Biology, Embryology and Genetics
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil -
Dr. André N.A. Goncalves
Laboratory of Immunology Applied to Aquaculture
Department of Cell Biology, Embryology and Genetics
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil -
Dr. Felipe N. Vieira
Laboratory of Marine Shrimp, Department of Aquaculture
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil -
Dr. Walter Q. Seifert
Laboratory of Marine Shrimp, Department of Aquaculture
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil -
Dr. Evelyne Bachère
Ifremer, UMR 5244, IHPE Interactions-Hosts-Pathogens-Environment, UPVD, CNRS
Université de Montpellier, 34095 Montpellier, France -
Dr. Rafael D. Rosa
Laboratory of Immunology Applied to Aquaculture
Department of Cell Biology, Embryology and Genetics
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil -
Dr. Luciane M. Perazzolo
Corresponding author
Laboratory of Immunology Applied to Aquaculture
Department of Cell Biology, Embryology and Genetics
Federal University of Santa Catarina
88040-900 Florianópolis, SC, Brazil


