Prof. Boyd: los cambios en el pH rara vez resultan en mortalidad

Además de la temperatura del agua y la concentración de oxígeno disuelto, el pH probablemente sea la variable de calidad del agua más frecuentemente medida en la acuacultura. Estas tres variables también probablemente exhiban los cambios más frecuentes y más grandes observados entre las variables de calidad del agua en los sistemas acuícolas. Los acuacultores saben por qué la temperatura del agua cambia y la mayoría puede dar una explicación aceptable de los motivos de los cambios en la concentración de oxígeno disuelto. La mayoría también comprende las consecuencias de la temperatura del agua y los cambios en la concentración de oxígeno disuelto.
Sin embargo, con respecto al pH, la mayoría no tiene ni idea, pero a menudo miden y se preocupan por los cambios de pH observados.
¿Qué es el pH?
Comenzaré recordando a los lectores el concepto de pH. El pH es un índice de la intensidad del ion de hidrógeno (H+). Por definición, el pH es el logaritmo negativo de la actividad H+ (concentración efectiva de H+). La actividad del ion de hidrógeno y la concentración de H+ generalmente son similares, y la concentración de H+ se usará aquí. En agua a 25 grados-C y pH 7, hay concentraciones de 0,0000001 molar (10-7 M) de H+ e ion hidroxilo (OH–), y el log negativo (pH) de 10-7 M es 7. La reacción de H+ es ácida, mientras que la reacción de OH– es básica (alcalina). Se deduce que a pH 7, el agua pura es neutra (ni ácida ni básica). Cuando H+ aumenta en relación con OH–, el pH cae por debajo de 7 y cuanto menor es el pH, mayor es la reacción ácida del agua. Cuando H + disminuye en relación con OH–, el pH aumenta por encima de 7 y cuanto mayor es el pH, mayor es la reacción básica del agua.
El pH influye en la supervivencia y el crecimiento de los animales acuícolas. Los efectos usuales en los animales acuáticos a la exposición continua a diferentes niveles de pH se ilustran en la Tabla 1. Con un pH de alrededor de 4 y entre 10 y 11, los animales acuáticos morirán. Por lo general, crecen mejor en el rango de pH 6,5-8,5, y el pH 7-8 probablemente sea óptimo para la mayoría de las especies.
Boyd, cambios de pH, Tabla 1
| pH | Efecto |
|---|
pH | Efecto |
|---|---|
| 4 | Punto de muerte ácida |
| 4-5 | Sin reproducción |
| 5-6 | Crecimiento lento |
| 6-9 | Mejor crecimiento |
| 9-11 | Crecimiento lento |
| 11 | Punto de muerte alcalina |
Manejo del pH
Esta clasificación de los efectos del pH en la Tabla 1 ha sido vista por la mayoría de los acuacultores, y puede ser la razón de gran parte de la preocupación por el pH. En estanques, el pH a menudo puede ser casi neutro en la mañana y elevarse por encima de 8,5 en la tarde. Los estanques altamente ácidos son encalados para aumentar el pH, y rara vez se observa un pH bajo en los sistemas de cultivo. Sin embargo, el pH en el rango de 9-10 es común, especialmente en la tarde.
El resultado es que el agua puede encalarse para evitar un pH bajo, pero un pH alto durante algunas horas en la tarde (o por algunos días en algunos casos) es una característica de las aguas de estanques acuícolas. El pH elevado seguramente influye en cierto modo en el crecimiento de los animales acuáticos, pero en realidad no existe una forma práctica de evitar sistemáticamente el pH elevado en la mayoría de los estanques. Una explicación simple de por qué el pH es diferente en aguas de algunas áreas que en otras y de por qué los valores de pH cambian rápidamente merece una explicación.
Las aguas más ácidas son aquellas que han entrado en contacto con suelos activos de sulfato de ácido. Los depósitos de pirita de hierro en tales suelos se oxidan, produciendo ácido sulfúrico que causan que el pH caiga tan bajo como 2 a 3. Tales suelos generalmente se encuentran en áreas costeras – son particularmente comunes en algunas áreas costeras de Australia y el sudeste asiático – pero se pueden encontrar en otras regiones. La mejor alternativa es rechazar áreas con tales suelos como sitios de estanques. Pero los estanques construidos en tales suelos pueden ser adecuados para la acuacultura al someterlos a períodos alternos de secado para oxidar la pirita y de enjuague para eliminar la acidez resultante. Luego, el encalado puede ser efectivo para mantener el pH dentro de un rango aceptable.
La razón más común para el bajo pH en los estanques es los suelos de la cuenca hidrográfica y del fondo que son altamente lixiviados y de pH bajo como resultado de una deficiencia de cationes básicos. El agua tiene baja alcalinidad y el pH generalmente es de 4,5 a 6,5. Hay grandes áreas en todos los continentes con tales suelos, por ejemplo, gran parte de la llanura costera del este de los Estados Unidos. Los estanques construidos en tales suelos pueden ser encalados y la limitación para la acuacultura por condiciones ácidas puede superarse fácilmente. Por lo general, los estanques se encalan para aumentar la alcalinidad a alrededor de 40 mg/ L, y esto elevará el pH mínimo, que normalmente ocurre a primera hora de la mañana, a 7 o 7,5.
En regiones donde los depósitos de piedra caliza son comunes y los suelos pueden contener carbonatos libres, las aguas superficiales pueden tener concentraciones de alcalinidad de 50 a 300 mg/L y el pH generalmente es cerca de 8. Las regiones áridas también tienden a tener aguas superficiales de alta alcalinidad, y en algunos casos, el pH puede estar muy por encima de 8, incluso por la mañana. Los estanques llenos de fuentes de agua salobre y de agua de mar tienen alcalinidades de 80 a 120 mg/L y un pH cercano a 8. En las aguas con una alcalinidad superior a 40 a 50 mg/L no suele ser necesario encalar.
En resumen, los estanques acuícolas deberían tener aguas con un pH superior a 6,5 y una alcalinidad suficiente, ya sea de forma natural o debido al encalado. El final utópico de la historia debería estar aquí, pero la historia no termina aquí.
Fluctuaciones de pH
El fenómeno de pH fluctuante ocurre en mayor o menor grado en casi todos los cuerpos de agua y es causado por procesos biológicos. En aguas con baja concentración de nutrientes (aguas oligotróficas), el cambio diario de pH es pequeño, rara vez excede de 0,5 a 1,0 unidades de pH (Fig. 1). En los estanques acuícolas se aplican fertilizantes y alimentos, y esto aumenta en gran medida la actividad biológica y se producen cambios de pH mucho más amplios durante un período de 24 horas (Figura 1).
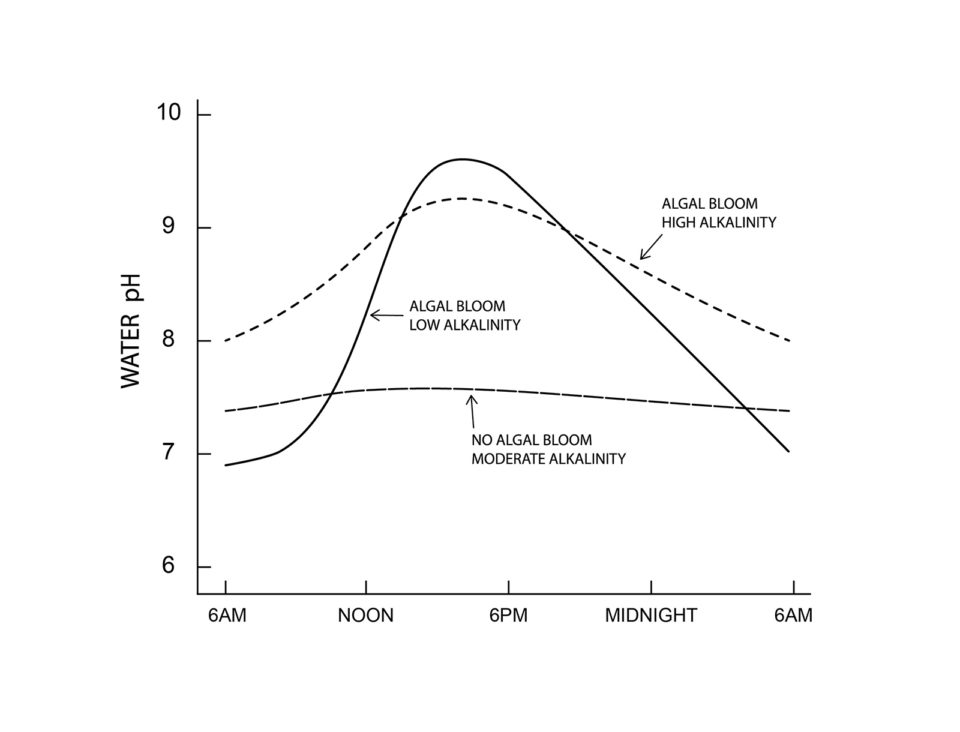
Le ahorraré al lector la compleja química del cambio de pH. Bastará aquí decir que el dióxido de carbono es ácido en el agua. Las floraciones de fitoplancton se desarrollan en estanques acuícolas debido a la abundante oferta de nutrientes. Durante el día, el fitoplancton elimina el dióxido de carbono para su uso en la fotosíntesis más rápido que la respiración de todos los organismos devuelve dióxido de carbono al agua, y el pH aumenta.
No hay dióxido de carbono en agua de pH 8,3 y superior. Muchas plantas acuáticas pueden usar carbono del bicarbonato, pero este proceso da como resultado un aumento del carbonato en el agua. El carbonato se hidroliza con la liberación de OH-, y el pH continúa aumentando a veces llegando a 10 o más. Por la noche, la fotosíntesis se detiene, pero la respiración continúa devolviendo el dióxido de carbono al agua. El resultado es que el carbonato se transforma de nuevo en bicarbonato, el pH desciende a 8,3 y el pH continúa cayendo en respuesta al aumento del dióxido de carbono.
El encalado de agua de baja alcalinidad aumenta la concentración de iones de bicarbonato para aumentar la alcalinidad. Una mayor alcalinidad proporciona una mayor capacidad de amortiguación para minimizar los cambios de pH.
Los eventos descritos anteriormente son procesos naturales y no existen medios prácticos para evitarlos en estanques u otros sistemas de producción acuícola que contengan fitoplancton. Aunque los cambios en el pH pueden afectar negativamente a los animales cultivados, rara vez producen mortalidad y el efecto sobre la producción es bastante menor.
Comentarios adicionales
Algunos puntos adicionales sobre el pH son necesarios. El pH puede aumentar a 11 o más en estanques con alta alcalinidad pero baja dureza de calcio. Un alto pH resulta porque la concentración de calcio no es suficiente para precipitar suficiente carbonato (carbonato de calcio) del agua para restringir que el pH se eleve por encima de un nivel tolerable. Los peces seguramente morirán en pocas horas a un pH superior a 11. La forma más común de mejorar esta situación es aplicar yeso agrícola (sulfato de calcio) para aumentar la concentración de dureza del calcio.
El uso de fertilizantes formadores de ácido como la urea o el sulfato de amonio en estanques con agua de alta alcalinidad y un pH crónicamente elevado a menudo se ha recomendado como un medio para reducir el pH. El argumento para el uso de estos fertilizantes es que dan como resultado una mayor concentración de amoniaco, y la oxidación del amoniaco por las bacterias nitrificantes produce H+ para bajar el pH. Si bien la lógica es correcta, la cantidad de fertilizante necesaria para tener un buen resultado aumentaría la concentración de amoníaco a niveles tóxicos en estanques con pH alto.
El ácido sulfúrico se puede aplicar para bajar el pH, pero el ácido sulfúrico neutraliza la alcalinidad, y el problema de pH alto pronto volvería y tal vez empeoraría. La alcalinidad en el agua sirve como un amortiguador de pH, y las aguas con mayor alcalinidad resisten mejor el cambio de pH que las de pH más bajo. El tratamiento con ácido sulfúrico reduce la alcalinidad y esto disminuye la capacidad de amortiguación que favorece un pH más alto más adelante.
El pH alto resultante de la fotosíntesis del fitoplancton es más extremo en climas cálidos y en estanques con floraciones densas de fitoplancton. Algunos gerentes han aplicado alguicidas para controlar la abundancia de fitoplancton. Matar una gran cantidad de fitoplancton disminuye el oxígeno disuelto de la fotosíntesis, y el fitoplancton muerto se descompone, removiendo el oxígeno disuelto y a veces resulta en estrés o mortalidad de los peces. Además, las floraciones de algas aumentarán nuevamente a medida que disminuya el efecto algicidal.
Aunque el pH se mide fácilmente por una variedad de medios – tiras de prueba, kits de prueba, dispositivos de pH tipo pluma y medidores electrónicos estándar – la mejor manera de medir el pH es con un medidor electrónico que ha sido cuidadosamente calibrado. Los otros métodos pueden ser considerablemente erróneos y la causa de algunos de los valores altos de pH que preocupan a los acuacultores.
Espero que esta discusión les de alguna comodidad a los que se preocupan por el pH crónico entre ustedes.
Author
-

Claude E. Boyd, Ph.D.
School of Fisheries, Aquaculture and Aquatic Sciences
Auburn University
Auburn, Alabama 36849 USA
Tagged With
Related Posts

Innovation & Investment
American Unagi regresa “a casa” la cría de anguilas
Sara Rademaker lanzó American Unagi para cambiar la cría de anguilas a suelo estadounidense, de donde provienen las anguilas. ¿Por qué? Debido a la novedad, y porque ella vio la oportunidad de hacer las cosas mejor.

Health & Welfare
¿Qué tan buenas son sus postlarvas de camarón?
El sembrar postlarvas de camarón de la mejor calidad, sanas y libres de patógenos, es un paso crítico de gestión con efectos significativos en la producción y rentabilidad de una granja de camarón.

Aquafeeds
Aprovechando el potencial de la harina de insectos en la acuacultura
Las moscas soldado negro están ganando interés como un ingrediente alternativo líder en alimentos acuícolas. ¿Pero creará el factor "desagrado" una aversión o rechazo? La colaboradora del Advocate Clare Leschin-Hoar investiga.

Responsibility
Conductividad eléctrica del agua, parte 1
La conductividad eléctrica del agua, comúnmente llamada conductancia específica o simplemente conductividad, es una propiedad importante del agua frecuentemente medida en los sistemas acuícolas, y proporciona una evaluación de la concentración total de iones disueltos en el agua.

