Profesor Boyd: Examinando la importancia de un parámetro de producción importante

La conductividad eléctrica se mide con frecuencia en los sistemas acuícolas y se toma como un indicador del grado de mineralización (concentración iónica total) del agua. Los principios y el método de medición de la conductividad se discutieron en el artículo anterior (parte 1). La presente discusión versará sobre la importancia de la medición de la conductividad en el agua.
Salinidad, sólidos disueltos totales
La salinidad es una medida de la concentración total de iones en el agua, y la mayoría de la concentración total de sólidos disueltos (TDS) – generalmente al menos 95 por ciento – proviene de iones disueltos. Por lo tanto, la conductividad está relacionada con la salinidad y la concentración de TDS. Esto ha dado como resultado el uso de una modificación del medidor de conductividad para medir directamente la salinidad y la concentración de TDS.
Esto se hace instalando un factor en el circuito de un medidor de conductividad convencional como medio de transponer las lecturas de conductividad para mostrar salinidad, sólidos disueltos totales o ambos. Algunos medidores tienen la capacidad de mostrar la conductividad en un ajuste y la salinidad, la concentración de TDS o ambos en otros entornos.
La salinidad y concentración de TDS se pueden medir con bastante precisión mediante métodos tradicionales. Sin embargo, los medidores para medir estas dos variables, por convenientes que sean, tienen limitaciones de precisión. Las conductividades de dos aguas de la misma concentración total de iones raramente serán idénticas. Esto resulta porque diferentes iones contribuyen de manera diferente a la conductividad.
El factor para convertir entre la conductividad y ambas la salinidad y la concentración de TDS es relativamente constante (aproximadamente 0,70) en aguas oceánicas en todo el mundo. También existe una buena relación entre la conductividad y la concentración de TDS (o salinidad) en el agua dulce de una región fisiográfica determinada (Fig. 1). Pero el factor para convertir la conductividad a la concentración de TDS o salinidad varía de alrededor de 0.55 a 0.8 cuando se considera en muchas regiones fisiográficas diferentes.
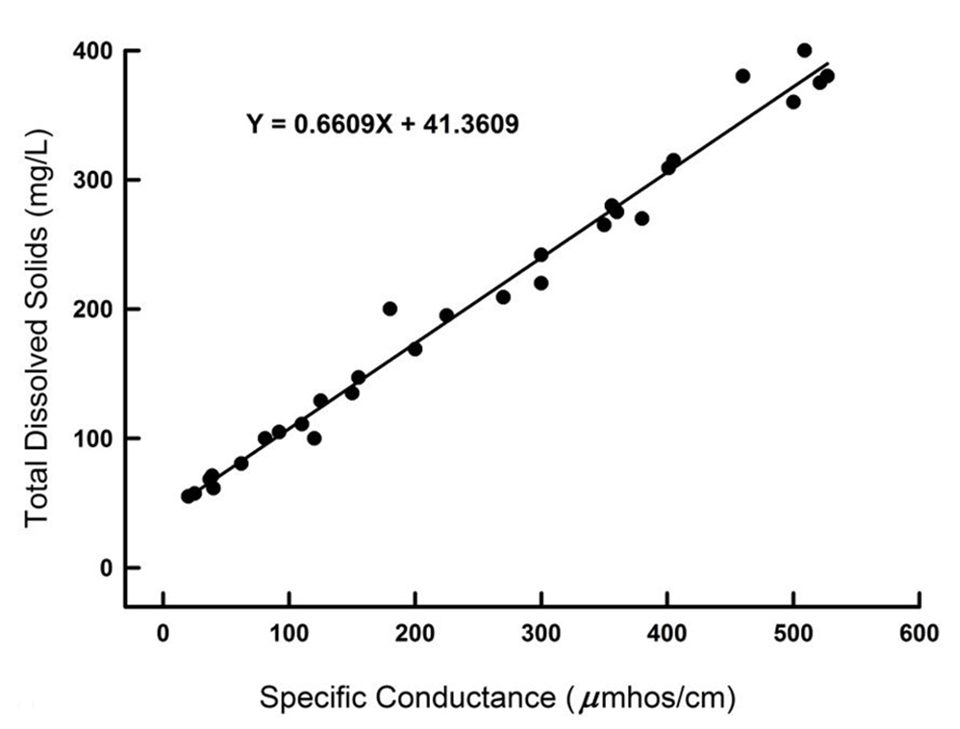
Además, los extremos superiores de los estuarios son más similares a las aguas dulces que al agua del océano en la composición iónica. No se puede esperar que un solo factor convierta adecuadamente la conductividad a la salinidad o la relación TDS en todas las aguas naturales. Obviamente, un error considerable puede dar como resultado la determinación de salinidad o concentración de TDS con conductímetros modificados.
El mejor enfoque es utilizar la conductividad como una indicación aproximada del grado de mineralización del agua. De esta forma, no es probable que haya errores importantes en la interpretación, y se pueden hacer inferencias sobre varias propiedades del agua, especialmente las propiedades coligativas. Las propiedades coligativas son cambios resultantes de sustancias disueltas que dependen de la cantidad total de todas las sustancias disueltas (solutos) y no del tipo de solutos en el agua.
Presión osmótica
Una propiedad coligativa más importante del agua para la acuacultura es el efecto de una mayor conductividad en la presión osmótica. La presión osmótica de una solución es la cantidad de presión o fuerza necesaria para evitar el flujo de moléculas de agua a través de una membrana semipermeable (las moléculas de agua pueden pasar la membrana, pero las moléculas de soluto no pueden) de una solución menos concentrada a una solución más concentrada, como se ilustra en la Fig. 2. Esto se debe a que los poros en la membrana que enfrenta el lado concentrado son bloqueados más frecuentemente por los iones que los que miran al lado menos concentrado; este resultado es un movimiento neto de agua hacia el lado concentrado.
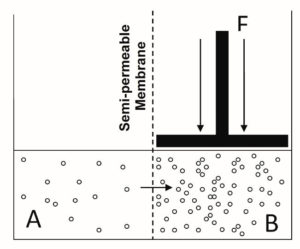
Al aplicar el concepto de presión osmótica (Fig. 2) a los animales acuáticos, los fluidos corporales de los animales acuáticos representan una solución, el agua circundante es la otra solución, y la parte del animal que separa las dos soluciones puede considerarse como la membrana . Los animales de agua dulce tienen fluidos corporales más concentrados en iones que el agua circundante; Son hipersalinos o hipertónicos a su entorno. Las especies de agua salada tienen fluidos corporales más diluidos en iones que el agua circundante; Son hiposalinos o hipotónicos para su entorno.
El pez de agua dulce tiende a acumular agua porque es hipertónico para el medio ambiente, por lo que debe excretar agua y retener iones para mantener su equilibrio osmótico. Debido a que el pez de agua salada es hipotónico para el medio ambiente, pierde agua al medio ambiente. Para reemplazar esta agua, el pez ingiere agua salada; pero para evitar la acumulación de exceso de sal, debe excretar sal. Cada especie tiene un rango de salinidad óptimo. Fuera de este rango, el animal debe gastar considerablemente más energía de lo normal para la osmorregulación a expensas de otros procesos como el crecimiento. Por supuesto, si la salinidad se desvía demasiado de la óptima, el animal morirá porque no puede mantener el equilibrio osmótico.
El efecto de aumentar la salinidad (y la presión osmótica) en la carpa común se muestra en la Tabla 1. Los peces gastan cada vez más energía para mantener el equilibrio osmorregulador a medida que aumenta la salinidad. Esto resulta en un menor crecimiento a mayor salinidad.
Boyd, conductividad, parte 2, Tabla 1
| Salinidad (ppt) | Energía alimentaria recuperada como crecimiento de los peces (%) |
|---|---|
| 0.5 | 33.4 |
| 2.5 | 31.8 |
| 4.5 | 22.2 |
| 6.5 | 20.1 |
| 8.5 | 10.4 |
| 10.5 | -1.0 |
Relevancia de la acuacultura
Las especies acuícolas tienen un rango de salinidad (que se puede estimar a partir de la conductividad) dentro del cual crecen mejor. Al seleccionar un sitio para cultivar especies particulares, la conductividad es una consideración importante.
La conductividad también influye en la corrosión de los metales, y puede afectar la corrosión de los equipos de aireación y otros equipos acuícolas con partes metálicas. Una mayor conductividad eléctrica aumenta el potencial de movimiento de electrones desde las áreas de los ánodos a las áreas de los cátodos en los objetos metálicos, lo que aumenta la tasa de corrosión.
La electro-pesca, una práctica común en el manejo pesquero para muestrear poblaciones de peces, también se ve afectada por la conductividad del agua. Sin embargo, la electro-pesca no se usa a menudo en la acuacultura. Los interesados en el tema deben leer la buena explicación del requisito de potencia eléctrica de la electro-pesca, en electrofishing.net/2016/03/04/power-transfer-theory-of-electrofishing-in-a-nutshell/.
Las sustancias disueltas en el agua ocupan espacio, y en la superficie de las aguas naturales, algunos de los espacios en contacto con el aire están ocupados por moléculas de soluto. La presión de vapor del agua es la presión en el aire resultante de las moléculas de agua cuando se alcanza el equilibrio entre el agua y las moléculas de agua en el aire por encima. Los solutos reducen la presión de vapor de las aguas naturales por debajo del agua pura, porque hay menos moléculas de agua en contacto con el aire que en el caso del agua pura.
El punto de ebullición del agua aumenta, el punto de congelación del agua se deprime y la velocidad de evaporación es mayor en el agua dulce que en el agua del océano como resultado de los efectos de los solutos en la presión de vapor.
SaveSave
Author
-

Claude E. Boyd, Ph.D.
School of Fisheries, Aquaculture and Aquatic Sciences
Auburn University
Auburn, Alabama 36849 USA
Tagged With
Related Posts

Responsibility
Conductividad eléctrica del agua, parte 1
La conductividad eléctrica del agua, comúnmente llamada conductancia específica o simplemente conductividad, es una propiedad importante del agua frecuentemente medida en los sistemas acuícolas, y proporciona una evaluación de la concentración total de iones disueltos en el agua.

Responsibility
Acuacultura Brasileña: Limitaciones y desafíos (Parte 1)
La acuacultura ha experimentado su mayor crecimiento en la última década (con un promedio de 8 por ciento por año) en comparación con otras industrias animales, pero todavía está muy por detrás de la producción alcanzada por las industrias avícola, bovina y porcina.

Intelligence
Acuacultura Brasileña: Limitaciones y desafíos (Parte 2)
La acuacultura de camarón marino y tilapia en Brasil se inició con una orientación a la exportación de sus productos. En 2003, más del 60 por ciento del camarón cultivado fue vendido en el extranjero. La industria de la tilapia soñaba sobre la exportación de filetes frescos a los Estados Unidos y Europa, y logro exportar algo.

Health & Welfare
Acuamimetismo: Un concepto revolucionario para el cultivo de camarón
El acuamimetismo simula las condiciones de producción naturales estuarinas mediante la creación de floraciones de zooplancton como nutrición suplementaria para los camarones cultivados, y bacterias beneficiosas para mantener la calidad del agua. Se pueden producir camarones de mejor calidad a un costo menor y de manera más sostenible.

