Profesor Boyd: Se espera poco efecto en los sistemas de acuacultura, pero mayor preocupación por el calentamiento global y el cambio climático

La concentración de dióxido de carbono atmosférico ha aumentado de un estimado de 280 partes por millón (ppm) al comienzo de la revolución industrial (alrededor del año 1750) a una medida de 406 ppm en 2017. Este aumento se debió principalmente a la combustión de combustibles fósiles y se espera que continúe.
Dióxido de carbono atmosférico
El dióxido de carbono es un gas de efecto invernadero, y se considera el principal factor antropogénico que causa el calentamiento global. El aumento de la concentración de dióxido de carbono atmosférico aumenta la solubilidad del dióxido de carbono en el agua. En 1978, la solubilidad del dióxido de carbono en agua pura a 1 atmósfera de presión y 20 grados-C fue de 0,56 mg/L. La solubilidad había aumentado a 0.67 en 2012 – un aumento de casi 12 por ciento.
El dióxido de carbono es ácido, porque reacciona para formar ácido carbónico. El aumento de la concentración de dióxido de carbono en el océano ha dado como resultado una disminución del pH promedio de los océanos de 8,12 en 1980 a 8,09 en 2008. Esto ha causado que algunas áreas en el océano estén por debajo de la saturación con carbonato de calcio.
La exposición de los organismos marinos calcificantes como los corales, los moluscos y algunos organismos planctónicos al carbonato de calcio en condiciones de saturación dificulta que las etapas más jóvenes de vida produzcan conchas bien formadas y las cáscaras de organismos maduros tienden a disolverse parcialmente. Los depósitos de las poblaciones silvestres y de acuacultura de algunas especies de calcáreos marinos son más delgados que en el pasado. Suponiendo que la tendencia a una mayor concentración de dióxido de carbono atmosférico continúe como se esperaba, tendrá consecuencias nefastas sobre las calcificaciones marinas y la trama alimentaria marina.
Alcalinidad en agua dulce
La alcalinidad en agua dulce deriva principalmente de la disolución de piedra caliza, silicato de calcio y feldespatos minerales. Una mayor solubilidad del dióxido de carbono como resultado del aumento de la concentración atmosférica de dióxido de carbono aumentará la solubilidad de estos minerales como se ilustra a continuación para una forma de piedra caliza, carbonato de calcio:
CaCO3 + CO2 + H2O ⇌Ca2+ + 2HCO3–.
La adición de dióxido de carbono impulsa la reacción hacia la derecha, dando como resultado más calcio (Ca2+) y bicarbonato (HCO3–). El calcio es un ion importante que causa dureza en el agua, mientras que el bicarbonato es la principal fuente de alcalinidad en la mayoría de las aguas dulces.
La solubilidad de una muestra de piedra caliza de una cantera cerca de Auburn, Ala., EE.UU., aumentó de 59 mg/L en 1980 a 62,7 mg/L en 2014. La alcalinidad promedio de más de 200 arroyos en Alabama aumentó de 41,6 mg/L en 1972 a 47,2 mg/L en 2014. Las concentraciones de dióxido de carbono en equilibrio en el agua resultantes de concentraciones de dióxido atmosférico que van desde 280 ppm estimados al comienzo de la revolución industrial hasta una concentración de 500 ppm (aproximadamente 100 ppm mayor que en la actualidad) mostrada en la Figura 1. También se presenta la alcalinidad de equilibrio resultante de la solubilidad del carbonato de calcio en las diferentes concentraciones de dióxido de carbono.

Efectos sobre pH, alcalinidad
Una mayor concentración de dióxido de carbono disminuirá el pH ligeramente a una alcalinidad dada en agua dulce, pero también causará una mayor alcalinidad (Fig. 2). Como resultado, el pH aumentará ligeramente a medida que aumenta la alcalinidad (Figura 2). El efecto general de una mayor concentración de dióxido de carbono atmosférico probablemente será un ligero aumento en el pH del agua dulce.
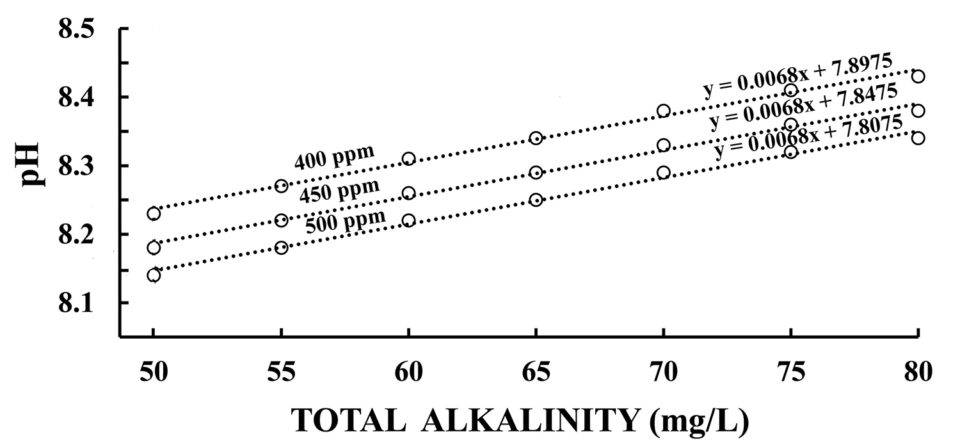
El océano derive su alcalinidad principalmente de los aportes de alcalinidad de la afluencia de agua dulce de las masas de la tierra. Sin embargo, el océano tiene un tiempo de retención hidráulica de unos 35.000 años, mientras que los cuerpos de agua dulce tienen unos tiempos de retención hidráulica de unos pocos meses (especialmente en el caso de los estanques acuícolas) a unos pocos años. La concentración creciente de dióxido de carbono atmosférico causará una mayor solubilidad de las fuentes de alcalinidad en las cuencas de captación de cuerpos de agua dulce y rápidamente causará el aumento de la alcalinidad en estos cuerpos de acopio. Sin embargo, se requeriría un tiempo mucho más largo para que la alcalinidad aumentara en el océano.
Una mayor alcalinidad aumentará la capacidad del agua con un pH de 8,3 o menos (el dióxido de carbono libre no existe en agua con un pH superior a 8,3) para contener dióxido de carbono como se ilustra para el pH 7 y 7,5 en la Fig. 3. La mayor parte del fitoplancton y otras plantas acuáticas pueden obtener dióxido de carbono a partir de bicarbonato en la ausencia de dióxido de carbono libre (pH por encima de 8,3). La creciente alcalinidad aumentará la disponibilidad de carbono inorgánico para la fotosíntesis en agua dulce.
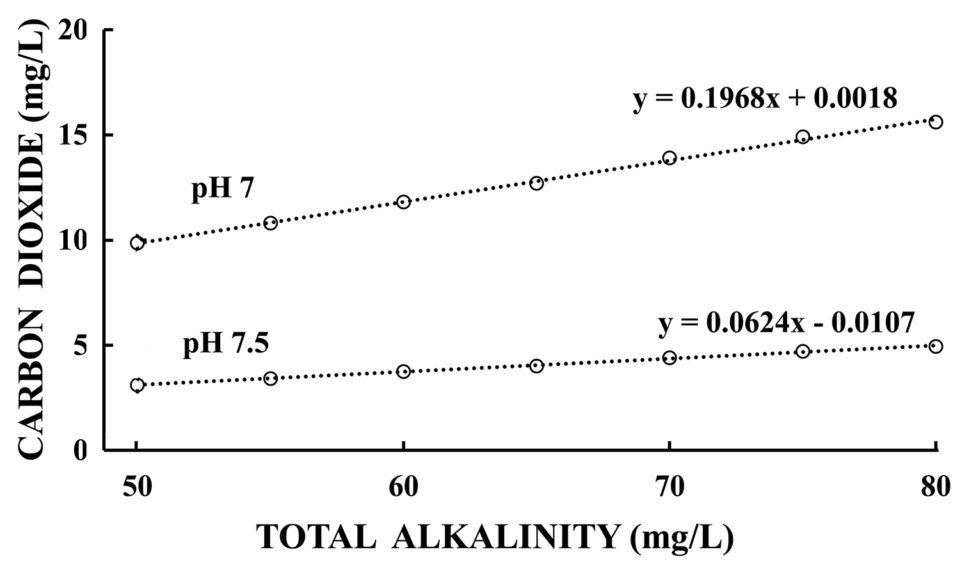
El aumento de la alcalinidad en las fuentes de agua para instalaciones acuícolas probablemente será relativamente menor. Proporcionará un pH ligeramente más bajo en equilibrio con el dióxido de carbono atmosférico para cualquier alcalinidad particular, pero debido al aumento de alcalinidad, el pH puede en realidad elevarse ligeramente sobre el normal actual. El resultado es que puede haber un poco más de carbono disponible para la fotosíntesis del fitoplancton, lo que hace que la productividad del fitoplancton sea un poco mayor. Además, en los estanques donde se requiere el encalado, los materiales de encalado se disuelven mejor a una mayor concentración de dióxido de carbono.
Perspectivas
Sin embargo, los efectos mencionados anteriormente no parecen puntos discutibles. La acuacultura se está volviendo cada vez más intensiva y basada en alimentos. La mayor liberación de dióxido de carbono en las aguas de los sistemas de cultivo por la respiración de los animales de cultivo y la descomposición de los alimentos no consumidos y las heces eclipsa la cantidad de dióxido de carbono que entra en los estanques desde la atmósfera.
El fitoplancton en estanques causa que el pH aumente durante el día eliminando el dióxido de carbono del agua para la fotosíntesis más rápido de lo que puede ser reemplazado por la combinación de difusión de la atmósfera y liberación por la respiración de la biota del estanque. Por la noche ocurre exactamente lo contrario y el pH cae. La oscilación del pH está determinada por la cantidad de fitoplancton y la capacidad de amortiguación del agua. La mayor capacidad de amortiguamiento del agua debido a una mayor alcalinidad debería compensar cualquier tendencia de mayor pH debido a la mayor fotosíntesis.
Debe haber poco efecto de la creciente concentración de alcalinidad en la acuacultura. Además, el pequeño aumento en la solubilidad de los materiales de encalado no debe ser lo suficientemente grande como para disminuir apreciablemente las tasas de encalado de los estanques ácidos. La creciente concentración atmosférica de dióxido de carbono tiene otros impactos que incluyen el calentamiento global y el cambio climático. Estos efectos son de mayor preocupación para la acuacultura de agua dulce que el aumento de la alcalinidad.
SaveSave
Author
-

Claude E. Boyd, Ph.D.
School of Fisheries, Aquaculture and Aquatic Sciences
Auburn University
Auburn, AL 36849 USA
Tagged With
Related Posts

Aquafeeds
Cerrando la brecha de omega-3 con metano, microalgas
La innovación está llevando a nuevas opciones de ingredientes para fuentes renovables de ácidos grasos omega-3. Pero la replicación de ácidos grasos de cadena larga es una tarea difícil, como descubrió la colaboradora del Advocate Lisa Duchene.

Health & Welfare
Cómo la descomposición de la materia orgánica impacta los estanques acuícolas
La descomposición de la materia orgánica causa la mayoría de los problemas de calidad del agua en los estanques acuícolas. Las poblaciones bacterianas son los organismos primarios de la descomposición en un sistema acuícola, incluyendo su materia orgánica.

Aquafeeds
Comprensión de la demanda de oxígeno de los alimentos acuícolas
Los alimentos acuícolas manufacturados, si se gestionan incorrectamente, pueden resultar en una demanda indeseable de oxígeno que puede reducir los niveles de oxígeno disuelto y causar contaminación a través de efluentes, y estrés a los animales cultivados.

Health & Welfare
Descomposición y acumulación de materia orgánica en estanques
Los estanques acuícolas acumulan materia orgánica de fertilizantes orgánicos, restos de micro-organismos producidos dentro del estanque, las heces de los animales criados y el alimento no-consumido. Claude E. Boyd, Ph.D., detalla las principales prácticas de gestión de la materia orgánica, y dice que frecuentemente la acumulación de materia orgánica no es tan grande como se creía.

