Un estudio sugiere potencial para aumentar la supervivencia, reducir FCR en un sistema de cultivo dominado por biofloc

En especies acuáticas, las bacterias intestinales dependen del ambiente externo y son de naturaleza transitoria, debido a la absorción continua de agua, alimentos y microorganismos asociados. Se ha demostrado que los probióticos cambian la microbiota intestinal compitiendo con los patógenos por nutrientes. La adición de probióticos a los alimentos puede, por lo tanto, contribuir a la salud general, lo que resulta en un aumento de la producción.
Biomin produce una línea de productos de acuacultura (AquaStar®) formulados para mejorar la producción de larvas y engorde de camarones o la calidad del agua del estanque. Cada producto consiste en varias cepas bacterianas probióticas, y AquaStar® Growout se diseñó para ser agregado a al alimento para mejorar la producción de engorde.
Ensayos previos con este probiótico en un sistema de tanque de agua clara con camarón blanco del Pacífico (Litopenaeus vannamei) en Vietnam dieron como resultado un mayor crecimiento, supervivencia y función inmune. A diferencia de los sistemas de agua clara, los sistemas dominados por biofloc contienen partículas agregadas formadas por diversos componentes, que incluyen bacterias, protozoos, detritus y alimento, y se asemeja más a un sistema basado en estanques.
En otro estudio, una combinación de este probiótico y AquaStar® Pond resultó en una mejor supervivencia y FCR en un sistema de producción de camarones bajo techo dominado por biofloc; sin embargo, el medio de cultivo estaba contaminado con Vibrio patógeno. La prueba actual se inició para determinar el impacto de tres niveles de probiótico AquaStar® Growout (2, 3 o 5 g/kg de alimento) en el rendimiento del camarón en un sistema de tanque de camarón intensivo y bajo techo dominado por biofloc.
Diseño experimental
Se llevó a cabo un estudio de 12 semanas en el Instituto Oceanográfico Harbor Branch de la Florida Atlantic University (FAU-HBOI) en Ft. Pierce, Fla., en un invernadero con clima controlado. Un diseño experimental de bloques aleatorios factoriales 4 × 4 consistió en dieciséis tanques cilíndricos de 1 m3 (4 pies de diámetro) equipados con sistemas de circulación de flóculos impulsados por aire y llenados con agua salada de pozo (34 ppt) (Fig. 1).

Se añadieron dieciséis litros de biofloc del biorreactor ex situ de Acuacultura Multi-Trófica Integrada (IMTA) de FAU-HBOI a cada tanque tres semanas antes de la adición del camarón. Cien camarones de 1,5 gramos se colocaron en cada tanque el 2 de mayo de 2017. AquaStar® Growout se agregó por encima al alimento Zeigler de camarones HI-35 (pellets de 2 mm) a 0, 2, 3 o 5 g/kg (0 por ciento, 0,2 por ciento, 0,3 por ciento o 0,5 por ciento).
El probiótico en polvo se añadió a agua destilada a una velocidad de dilución de 1:20 según las instrucciones de la etiqueta y se secó durante la noche a 65 grados-C. Los camarones fueron alimentados inicialmente dos veces al día manualmente (semanas uno y dos), después de lo cual el alimentó se aplicó de forma continua utilizando comederos de cinta basados en el peso corporal.
El oxígeno disuelto (DO), la temperatura y la salinidad se midieron dos veces al día y los sólidos fragmentables o asentables (SS) se midieron una vez al día usando conos Imhoff. Se midieron sólidos suspendidos totales (TSS), alcalinidad, nitrógeno total de amoníaco (TAN), nitritos (NO2-N) y nitratos (NO3-N) dos veces a la semana. Se añadió bicarbonato de sodio según fue necesario para mantener la alcalinidad entre 100 y 150 mg/L.
Diez camarones fueron removidos semanalmente de un tanque designado por tratamiento y se registraron los pesos. La supervivencia promedio, el peso final, el rendimiento, la tasa de crecimiento específico, la tasa de crecimiento semanal y la tasa de conversión alimenticia se evaluaron en la cosecha. Se recogió agua semanalmente de cada tanque y se sembró por triplicado en agar TCBS Vibrio selectivo.
En la terminación experimental, el agua se plaqueó adicionalmente en agar marino (MA) para determinar los recuentos bacterianos totales y en placa de agar MacConkey (MAC) para determinar los recuentos de bacterias entéricas. En la cosecha, el tracto intestinal de cinco camarones de cada tanque se recolecto, se mezcló, se maceró y se sembró en placas TCBS, MA y MAC.
Resultados
La calidad del agua fue similar para todos los grupos de tratamiento. Los niveles de temperatura, salinidad, pH y oxígeno disuelto promediaron 28,2-28,9 grados-C, 38 gramos/L, 7,6 y 6,6 mg/L, respectivamente. TAN, NO2-N, NO3-N y alcalinidad promediaron 0,05 mg/L, 0,04 mg/L, 4,4-4,7 mg/L y 139-142 mg/L, respectivamente. Los sólidos asentables aumentaron de un promedio de 8 ml/L a 29 ml/L y los TSS aumentaron de 78 a 306 mg/L durante el período de 12 semanas.
Los resultados de producción se muestran en la Tabla 1. Aunque hubo una tendencia hacia una mayor supervivencia (p = 0,056), el rendimiento (p = 0.059) y un menor FCR (p = 0,060) en las diferencias de tratamiento del 0,5 por ciento, no fueron significativas. La supervivencia promedio fue del 76,5 por ciento y la más alta en el tratamiento del 0,5 por ciento. El camarón alcanzó un promedio de 23,25 gramos en 12 semanas, con una tasa de crecimiento semanal promedio de 1,5 gramos. El rendimiento promedio por tanque fue de 1,556 gramos, y el más alto en el tratamiento de 0.5 por ciento. El FCR promedio fue de 1,39 y el más bajo en el tratamiento de 0,5 por ciento.
Laramore, AquaStar, Tabla 1
| Parámetro | 0% | 0.2% | 0.3% | 0.5% |
|---|---|---|---|---|
| Supervivencia (%) | 73±10 | 67±10 | 81±6 | 85±7 |
| Peso final (gramos) | 23.9±2.6 | 24.7±1.3 | 21.9±1.3 | 22.1±3.0 |
| Crecimiento seminal (g) | 1.9±0.22 | 2.0±0.13 | 1.7±0.11 | 1.7±0.25 |
| Rendimiento (g/tanque) | 1,489±79 | 1,374±325 | 1,599±69 | 1,766±154 |
| FCR | 1.4±0.08 | 1.6±0.43 | 1.3±0.06 | 1.2±0.10 |
Los conteos de Vibrio en la columna de agua comenzaron a aumentar en la semana cuatro y los picos se notaron en las semanas 7 y 12. Hubo una tendencia hacia conteos de Vibrio patogénicos (verde) más bajos a medida que aumentaba la cantidad de probiótico; en promedio, el Vibrio patógeno constituía el 17 por ciento del total de Vibrio en el control, el 13 por ciento en el 0,2 por ciento y el 0,3 por ciento de los grupos de tratamiento, y el 8.5 por ciento en el 0.5 por ciento del grupo de tratamiento (Fig. 2). Las muestras de agua recolectadas en la cosecha no mostraron diferencias entre los tratamientos en conteos totales de bacterias (MA) o Vibrio; sin embargo, la cantidad de crecimiento bacteriano en Agar MacConkey fue en promedio 10 veces menor (p = 0,045) (Figura 3A).

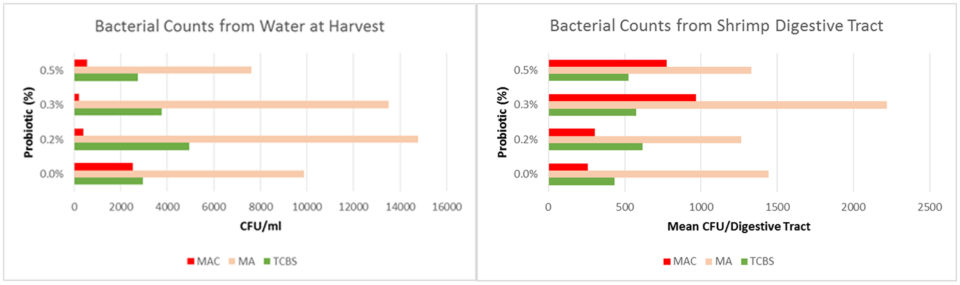
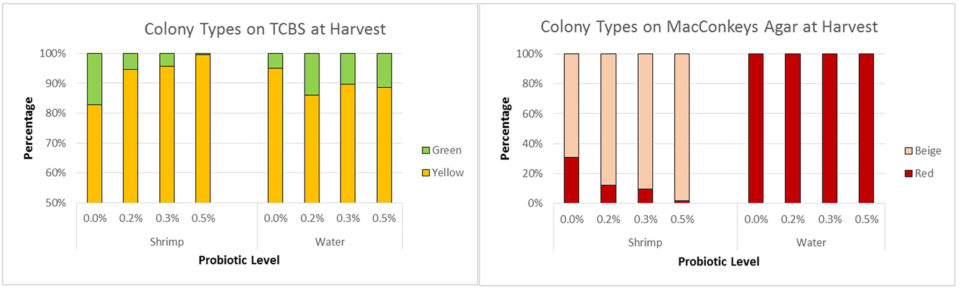
No hubo diferencia en los recuentos bacterianos medios de los tractos intestinales de camarón recolectados en la cosecha (Fig. 3B). Sin embargo, la composición de Vibrio y bacterias entéricas fue alterada por el probiótico. Los camarones en el tratamiento de control tuvieron un mayor porcentaje de Vibrio patógeno, a pesar de que el porcentaje de Vibrio patógeno en el agua fue menor (Fig. 4A). Los camarones en los tratamientos probióticos tuvieron un menor porcentaje de colonias de color beige (sin fermentación de lactosa) en comparación con las colonias rojas (fermentación de lactosa); no se detectaron colonias beige en ninguna muestra de agua (Fig. 4B).
Perspectivas
Aunque no se observaron diferencias significativas en términos de aumento de la producción, se observaron diferencias en la composición bacteriana tanto en el agua como en el tracto intestinal del camarón. La preponderancia de la evidencia sugiere que la incorporación de este producto probiótico, particularmente al 0,5 por ciento, tiene el potencial de impactar positivamente la salud y la producción del camarón al aumentar la supervivencia y así reducir el FCR.
Referencias disponibles del primer autor.
Authors
-
Susan Laramore, Ph.D.
Corresponding author
Harbor Branch Oceanographic Institute at Florida Atlantic University
Fort Pierce, Florida 34946 USA[117,100,101,46,117,97,102,64,49,111,109,97,114,97,108,115]
-
Tzachi Samocha, Ph.D.
Marine Solutions and Feed Technology, LLC
Spring, Texas USA -
Rui A. Gonçalves
BIOMIN Holding GmbH
Erber Campus 1, 3131 Getzersdorf, Austria -
Jutta Kesselring
BIOMIN Holding GmbH
Erber Campus 1, 3131 Getzersdorf, Austria
Tagged With
Related Posts

Health & Welfare
Acuamimetismo: Un concepto revolucionario para el cultivo de camarón
El acuamimetismo simula las condiciones de producción naturales estuarinas mediante la creación de floraciones de zooplancton como nutrición suplementaria para los camarones cultivados, y bacterias beneficiosas para mantener la calidad del agua. Se pueden producir camarones de mejor calidad a un costo menor y de manera más sostenible.

Health & Welfare
Evaluación de probióticos suplementarios de Bacillus en juveniles de camarón blanco
Los resultados de un estudio de alimentación que suplemento probióticos en la dieta mostraron que cuando las especies de Bacillus fueron complementadas en una concentración adecuada en los alimentos, el crecimiento y la eficiencia alimenticia del camarón blanco podrían mejorarse.

Health & Welfare
Lo pequeño es grande: Desbloqueando el potencial oculto de los microbios para la acuacultura
Las poblaciones microbianas tienen diversos roles – muchos de los cuales aún no se entienden completamente – en los organismos acuícolas, desde el intestino hasta las branquias, y una mejor comprensión e innovación de este mundo oculto podría desbloquear un potencial que podría cambiar por completo la práctica de la acuacultura.

Health & Welfare
Probióticos benefician al camarón blanco del Pacífico desafiado con AHPND
Un estudio fue llevado a cabo para medir los efectos de probióticos comerciales en camarón blanco del Pacífico en un modelo de desafío a AHPND estandarizado bajo condiciones controladas de laboratorio. Los resultados muestran que los tratamientos de probióticos por sí mismos tienen efectos beneficiosos, como una mayor supervivencia y signos histológicos de regeneración de hepatopáncreas.


