Ambos biocidas probados tuvieron un efecto inhibidor sobre la tasa de extrusión de esporas
Microsporidia es un vasto phylum [rango taxonómico para organismos que comparten un plan corporal similar] compuesto por más de 1400 especies de organismos eucariotas [aquellos cuyas células tienen un núcleo encerrado dentro de una envoltura nuclear], parásitos unicelulares e intracelulares relacionados con hongos. Son capaces de infectar una amplia variedad de huéspedes acuáticos y convertirse en un patógeno de gran relevancia en el medio acuático donde ha sido un problema emergente. En 2004, se reportó por primera vez de un microsporidio no identificado en el hepatopáncreas de especímenes de camarón tigre negro (Penaeus monodon) afectados por un crecimiento lento en Tailandia.
Sin embargo, no fue sino hasta 2009 cuando este patógeno fue plenamente caracterizado e identificado como Enterocytozoon hepatopenaei (EHP), y la gravísima enfermedad que provocó en el camarón como la Microsporidiosis Hepatopancreática (HPM). Este patógeno se ha encontrado en el camarón tigre negro, el camarón patiblanco (P. vannamei) y posiblemente el camarón kuruma (Marsupenaeus japonicus), y se ha reportado en algunos países con importantes industrias acuícolas de camarón, como China, Vietnam, Indonesia, Brunéi, India, Malasia, la región de Australasia (sospechosa), Venezuela y México (posiblemente especies diferentes).
El EHP puede transmitirse horizontalmente a través de la convivencia con especímenes infectados, canibalismo, agua, suelo o equipo contaminados. El ciclo de vida de los microsporidios se divide en tres etapas principales, que incluyen la proliferativa (merogenia), la producción de esporas (esporogenia) y la etapa infecciosa (espora madura). Las esporas son generalmente de forma ovoide, de tamaño pequeño de ~ 1 a 4 μm y contienen un filamento polar de cuatro a cinco espirales que se pueden extruir y utilizar para perforar células hospedadoras e inyectar materiales infecciosos. Se pueden encontrar en los túbulos epiteliales hepatopancreáticos. Durante muchos años, se ha reportado que el principal signo de infección por EHP es un crecimiento retardado en los camarones afectados y sin signos externos visibles; sin embargo, estas infecciones pueden ser un factor de riesgo para que los patógenos oportunistas puedan iniciar infecciones secundarias.
https://www.aquaculturealliance.org/advocate/sindrome-de-heces-blancas-en-camarones-predictor-de-ehp/
A medida que la industria del cultivo de camarón se intensifica y aumenta su producción, las enfermedades continúan desempeñando un papel importante en su éxito. Un enfoque ampliamente utilizado para tratar enfermedades en granjas acuáticas es la aplicación de productos químicos bajo estrategias de prevención o remedio para controlar los impactos de las enfermedades y el medio ambiente en el estanque. En el caso del EHP, hubo confusión sobre sus agentes causantes, y generalmente se relacionaba con otras enfermedades como la Necrosis Hepatopancreática Aguda (AHPND), también conocida como Síndrome de Mortalidad Temprana (EMS).
A partir de los resultados anteriores de un modelo de desafío de coinfección, se llegaron a varias conclusiones importantes sobre la destrucción progresiva de los tejidos hepatopancreáticos y la susceptibilidad de los camarones a Vibrio spp. causando AHPND / EMS y Necrosis Hepatopancreática Séptica (SHPN).
Además, otro estudio encontró una correlación entre EHP y el Síndrome de Heces Blancas (WFS) mientras se cuantificaban cantidades masivas de esporas de EHP en las heces de camarones infectados con WFS. El diagnóstico de EHP puede realizarse mediante microscopía (montaje húmedo de tejido hepatopancreático), métodos moleculares (PCR) y análisis de tejidos (histología o hibridación in situ).
El desarrollo de tensioactivos de superficie y el tratamiento farmacológico para EHP es uno de los métodos adecuados para controlar la EHP. Existe todavía una oportunidad para un gran número de productos que pueden ser estudiados por su idoneidad para tratar y controlar las infecciones por EHP, como los biocidas [sustancias químicas utilizadas para destruir o controlar organismos nocivos]. En este artículo se presentan los resultados y observaciones obtenidos al estudiar el efecto biocida de dos productos comerciales, Aqua-Protect y Antizol (fabricados por Virbac Vietnam). El objetivo de este estudio fue determinar el potencial de estos dos agentes biocidas contra la extrusión de esporas de EHP en condiciones de laboratorio mediante estudios in vitro.
Configuración del estudio
Se obtuvieron dos lotes diferentes de camarones infectados con EHP de dos fuentes geográficamente diferentes: las provincias de Pathum Thani (Lote 1) y Chanthaburi (Lote 2) en Tailandia. Estos camarones fueron aclimatados a temperaturas que oscilaron entre 28 y 29 grados-C con aireación constante en el laboratorio durante 2 días (Unidad de Servicio en Centex Shrimp, Universidad de Mahidol, Bangkok) antes de que se recolectaran sus hepatopáncreas y se usaran para la purificación de esporas de EHP según el método publicado de Aldama-Cano et al. (2018). La tasa de extrusión de esporas se midió y se reportó como 77,0 ± 2,65 por ciento y 70,3 ± 2,08 por ciento, respectivamente, para los Lotes 1 y 2 de las esporas de EHP.
La preparación de las soluciones de prueba de los dos biocidas comerciales fue la siguiente: Aqua-Protect y Antizol se diluyeron en agua destilada para obtener soluciones madre iniciales de 1000 ppm, que luego se diluyeron a 1, 5 y 10 ppm para Aqua-Protect, y 10 , 20 y 40 ppm para Antizol para probar en el Lote 1 de las esporas de EHP. Para el Lote 2 de las esporas de EHP, Aqua-Protect se diluyó a 1, 5, 10 y 20 ppm, y Antizol se diluyó a concentraciones de trabajo de 10, 20, 40 y 80 ppm de la reserva de 1000 ppm (Tabla 1). Para ambos lotes, las diluciones se prepararon de 10 a 20 minutos antes de agregar las esporas activas purificadas y el experimento se llevó a cabo a temperatura ambiente (~ 25 grados-C).
Phan, extrusión de esporas de EHP, Tabla 1
| Compuesto biocida | Lote 1 de EHP | Lote 2 de EHP |
|---|
Compuesto biocida | Lote 1 de EHP | Lote 2 de EHP | |||||
|---|---|---|---|---|---|---|---|
| Aqua-Protect | 1 ppm | 5 ppm | 10 ppm | 1 ppm | 5 ppm | 10 ppm | 20 ppm |
| Antizol | 10 ppm | 20 ppm | 40 ppm | 10 ppm | 20 ppm | 40 ppm | 80 ppm |
En cuanto a los ensayos de extrusión de esporas, los ensayos de inhibición de esporas de EHP se realizaron en tubos de reacción de 100 µL. Cada tubo se preparó agregando esporas de EHP purificadas a cada concentración de los productos diluidos para lograr la concentración final de esporas de 104 esporas / µL. Las pruebas de control se realizaron en agua destilada estéril (SDW) en lugar de soluciones de prueba. Todas las reacciones se incubaron durante 120 minutos a temperatura ambiente (~ 25 grados-C). Para calcular la velocidad de extrusión, se depositaron 3 µl de cada reacción en un portaobjetos de vidrio junto con 10 µl de floxina B al 2 por ciento y 10 µl de celulosa al 0,2 por ciento, después de lo cual se incubaron durante 10 minutos. Se contaron cien esporas y se puntuaron como esporas extruidas o no extruidas. Cada reacción se contó bajo un microscopio tres veces para calcular una velocidad de extrusión media que, a su vez, se dividió por la velocidad de extrusión del tratamiento de control correspondiente de cada lote para calcular la velocidad de extrusión normalizada (Fig. 1).
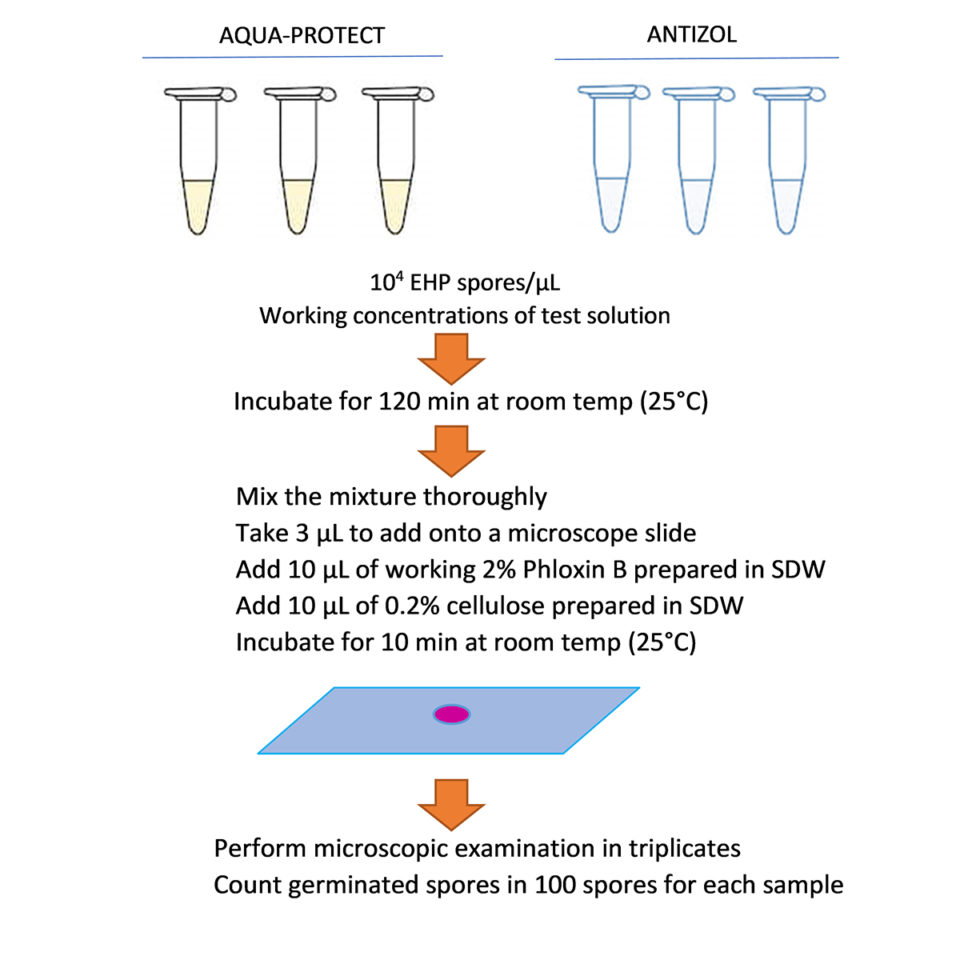
Los datos se analizaron mediante el análisis de varianza unidireccional (ANOVA), utilizando SPSS versión 22 (IBM). Se aplicó la prueba post-hoc de rango múltiple de Duncan para múltiples comparaciones de diferencias significativas entre tratamientos (p <0.05).
Resultados y discusión
Las pruebas de extrusión de esporas in vitro se llevaron a cabo con dos lotes de esporas de EHP recolectadas de dos fuentes diferentes de camarones infectados con EHP. Las tasas de extrusión de los tratamientos de control fueron ~ 77,0 por ciento y ~ 70,3 por ciento del primer y segundo lote de esporas, respectivamente (Tabla 1). Estos valores se utilizaron para normalizar la velocidad de extrusión de las esporas tratadas en sus respectivos lotes experimentales.
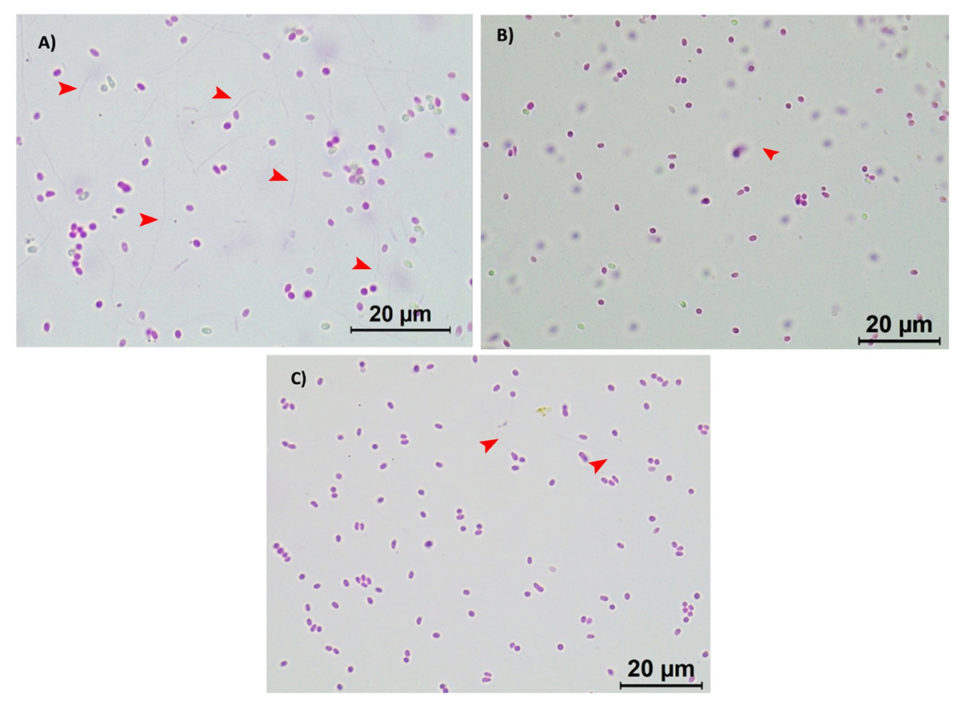
Se observó que ambos lotes de esporas de EHP activas respondieron a los tratamientos con los biocidas de manera similar. Bajo un microscopio óptico (Leica, aumento de 100 ×), se puede observar un alto número de esporas extruidas en el tratamiento de control (Fig.2 A; donde los tubos polares han sido extruidos demostrando su etapa activa e infecciosa), mientras que una reducción significativa de la extrusión del tubo polar se observó en las esporas de EHP activas tratadas con 20 ppm de Aqua-Protect (Fig. 2B) y 80 ppm de Antizol (Fig. 2C). El análisis estadístico indicó una diferencia significativa (p <0,05) en las velocidades de extrusión de esporas de EHP después de ser tratadas con los biocidas (Tabla 2 y Fig. 3).
Phan, extrusión de esporas de EHP, Tabla 2
| Aqua-Protect | Lote 1 | Lote 2 | Antizol | Lote 1 | Lote 2 |
|---|
Aqua-Protect | Lote 1 | Lote 2 | Antizol | Lote 1 | Lote 2 |
|---|---|---|---|---|---|
| Control | 100±2.65a | 100±2.08A | Control | 100±2.65x | 100±2.08X |
| 1 ppm | 59.74±3.61b | 80.57±3.79B | 10 ppm | 9.96±1.15y | 17.06±1.00Y |
| 5 ppm | 38.96±8.66c | 33.18±6.66C | 20 ppm | 14.29±1.00y | 9.00±2.52Y |
| 10 ppm | 36.80±3.51c | 18.96±3.51D | 40 ppm | .36±1.53y | 9.00±2.31Y |
| 20 ppm | N/D | 4.74±0.58E | 80 ppm | N/D | 3.32±1.53Y |
N/D – Not Done. Different superscripts are significantly different from one another in the same column (p < 0.05). Uppercase letters and lowercase letters represent data from each batch of EHP spores tested.
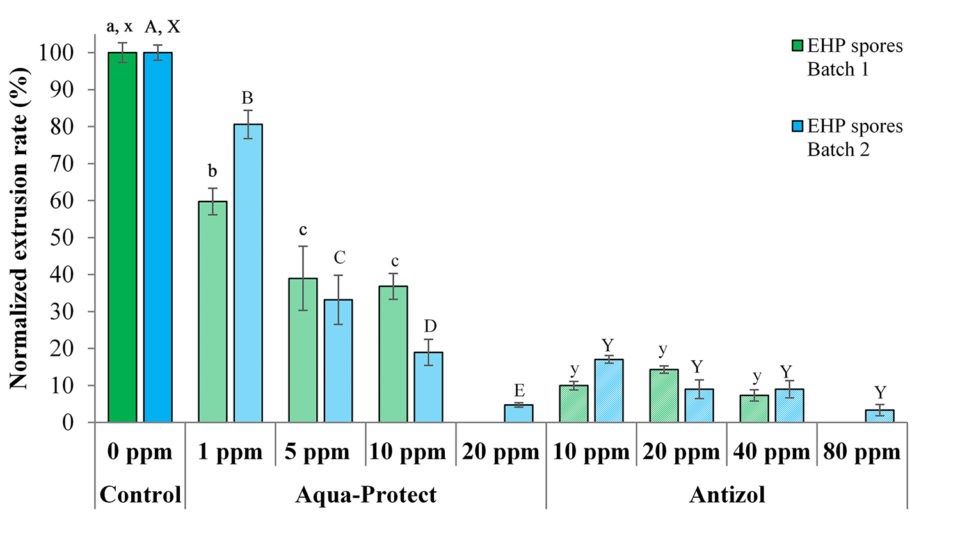
Los datos de las pruebas muestran que los biocidas fueron eficaces contra ambos lotes de esporas de EHP inhibiendo la extrusión del tubo polar de esporas después de 120 minutos de incubación (Tabla 2 y Fig. 3). Para Antizol, las tasas máximas de inhibición variaron del 92,6 por ciento (Lote 1, 40 ppm) al 96,7 por ciento (Lote 2, 80 ppm), mientras que para Aqua-Protect las tasas de inhibición fueron del 63,2 por ciento (Lote 1, 10 ppm) a 95,2 por ciento (lote 2, 20 ppm).
Comparando los dos productos, Antizol fue más efectivo que Aqua-Protect a la misma dosis de 10 ppm, mientras que Aqua-Protect fue más efectivo que Antizol a la dosis de 20 ppm (Tabla 2 y Fig. 3). Se encontró que el efecto inhibidor de Aqua-Protect depende de la dosis ya que un aumento en la concentración de 1 ppm a 20 ppm condujo a una disminución en la velocidad de extrusión. Sin embargo, la velocidad de extrusión en respuesta a la aplicación de Antizol no disminuyó significativamente ya que la dosis aumentó de 10 ppm.
Conclusión
Los resultados de nuestro estudio presentado aquí mostraron que los biocidas Aqua-Protect y Antizol tuvieron un efecto inhibidor sobre la tasa de extrusión de las esporas de EHP cuando se trataron in vitro en condiciones de laboratorio. Si bien ambos biocidas parecen inhibir la extrusión en un entorno de laboratorio estricto, es necesario considerar varios factores al optimizar los procedimientos para su uso en el campo, como los niveles de toxicidad para los animales (los datos están disponibles), los métodos / estrategias de aplicación, las concentraciones óptimas de trabajo, área o volumen de agua a tratar y otras consideraciones.
También sería necesario determinar si un enfoque profiláctico o preventivo es más adecuado que un enfoque correctivo, ya que se ha recomendado que la mayoría de los productos químicos evaluados para posiblemente combatir las infecciones por EHP se utilicen entre períodos de cultivos como medida preventiva de bioseguridad. Una vez que se determine el mejor enfoque, el uso de desinfectantes como biocidas para controlar las infecciones por EHP podría convertirse en una práctica común tanto para los camaroneros afectados como para los no afectados.
Referencias disponibles del autor correspondiente.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola mundial y compartir el conocimiento expansivo de nuestra amplia red de colaboradores cada semana.
Al hacerse miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que hacemos a través de los beneficios, los recursos y los eventos para los miembros pueda continuar. La membresía individual cuesta solo $50 al año. Este año, los miembros individuales y corporativos de GAA reciben acceso gratuito a la conferencia virtual GOAL en octubre. Hágase miembro ahora.
Authors
-
Khanittha Sang-Ngam
Virbac, Aquaculture Division, France
-
Diva J. Aldama-Cano, Ph.D.
Center of Excellence for Shrimp Molecular Biology and Biotechnology (CENTEX Shrimp)
Mahidol University, Thailand -
Ornchuma Itsathitphaisarn, Ph.D.
Center of Excellence for Shrimp Molecular Biology and Biotechnology (CENTEX Shrimp)
Mahidol University, Thailand -
Philippe Mahl
Virbac, Aquaculture Division, France
-
Phuong Do
Virbac, Aquaculture Division, France
-
Tagged With
Related Posts

Health & Welfare
El microsporidio Perezia sp. y la enfermedad de algodón del camarón
Un estudio analiza muestras de camarones infectados con microsporidios en Madagascar, Mozambique y Arabia Saudita, y con signos clínicos de enfermedad de algodón del camarón.

Intelligence
Podemos crecer un mejor camarón, y de mejores maneras
El reciente Simposio Centroamericano de Acuicultura en Choluteca, Honduras, reunió a más de 600 participantes para discutir temas de la industria y sus perspectivas. La atención se centró en enfermedades del camarón y sus impactos en la producción, así como en alternativas prácticas.

Intelligence
La producción actual, desafíos y el futuro del cultivo del camarón
En el Simposio de Acuacultura de Guatemala en Antigua, el enfoque fue el cultivo de camarón en la región: producción, nutrición, gestión de la salud y mercados.

Health & Welfare
Síndrome de Heces Blancas en Camarones: ¿Predictor de EHP?
Un estudio demuestra una fuerte asociación entre el Síndrome de las Heces Blancas y Enterocytozoon hepatopenaei en regiones endémicas de EHP. Las estrategias de bioseguridad pueden minimizar el riesgo de propagación de patógenos en las Américas.


