Detección temprana, respuesta de emergencia adecuada puede detener la progresión de una epidemia

Historia de caso
Este informe de caso clínico ocurrió en una instalación de producción de camarón blanco del Pacífico (Penaeus vannamei) ubicada en la costa del Pacífico de América Central. El evento de enfermedad aguda fue en uno de cinco tanques de pre-cría de 100 toneladas que se habían sembrado el mismo día de un lote común de postlarvas (PL). La densidad de siembra fue de 1.5 millones de PL/tanque (15 PL/L). PL enfermas y moribundas no se observaron (en ese momento o posteriormente) en los otros cuatro tanques de pre-cría en el edificio cerrado.
El manejo rutinario y diario de los cinco tanques incluyó un flujo de agua continuo con un 10 a 20 por ciento de recambio de agua. Se administró un alimento comercial en migaja importado de 350 micras (tamaño de partícula) cada dos horas a todos los tanques sembrados en el edificio. Los fondos de tanques no se inspeccionaban rutinariamente ni se sifoneaban para extraer el sedimento acumulado. Productos probióticos no se usaron en los tanques antes o después del inicio de la enfermedad. No se aplicaron otras medidas rutinarias de manejo químico o biológico en los cinco tanques.
Observaciones clínicas
El inicio de los signos clínicos se produjo en PL16, que fue cuatro días después de que los tanques habían sido sembrados. El día del inicio de la enfermedad, los parámetros de calidad del agua de referencia incluyeron una temperatura del agua 28.7 grados-C, salinidad 29 ppt y oxígeno disuelto (OD) 5.3 mg/L (se utilizó aireación permanente con sopladores). El pH del agua no se midió. La turbidez se consideró alta, pero las mediciones del disco Secchi no se registraron, con abundantes grumos suspendidos de materia orgánica en la columna de agua de los cinco tanques. La turbidez era tal que los fondos del afectado, así como de los otros tanques de pre-cría, no eran visibles cuando los tanques estaban llenos.
La mayor parte de las PL16 parecían no afectadas en el tanque. Las PL16 anormales tenían los hepatopáncreas (HP) encogidos y blanquecinos (HP), decoloración corporal blanquecina, intestino vacío, natación superficial errática y pérdida del “reflejo de escape.” El diagnóstico presuntivo fue AHPND para la enfermedad y el diagnóstico diferencial presuntivo fue enfermedad de la mancha blanca (WSD) o toxicosis química (por ejemplo, amoníaco).

Aproximadamente a las 7 a.m., los técnicos de pre-cría informaron a la gerencia que se observaron PL enfermas y moribundas en el tanque 6. Después de la consulta y discusión entre el personal y los gerentes a las 10 a.m., se iniciaron los pasos de intervención abajo:
Pasos de intervención tomados
- El nivel del agua se bajó en el tanque.
- El detritus acumulado (que era inusualmente abundante) se sifoneo del tanque 6, se realizó un recambio de agua del 200 por ciento y se rellenó el tanque.
- Posteriormente, se realizó una reemplazo de agua del 100 por ciento y un sifoneo del fondo para eliminar los detritus, y si se había consumido el alimento previamente administrado, se volvió a aplicar alimento nuevo (40 por ciento de proteína, de alta calidad para PL). Esto se continuó hasta que el tanque de PL se cosechó 5 días después del inicio.
A medida que progresó la intervención del tanque, el personal recolectó y conservó muestras de PL moribundas para análisis de PCR e histología.
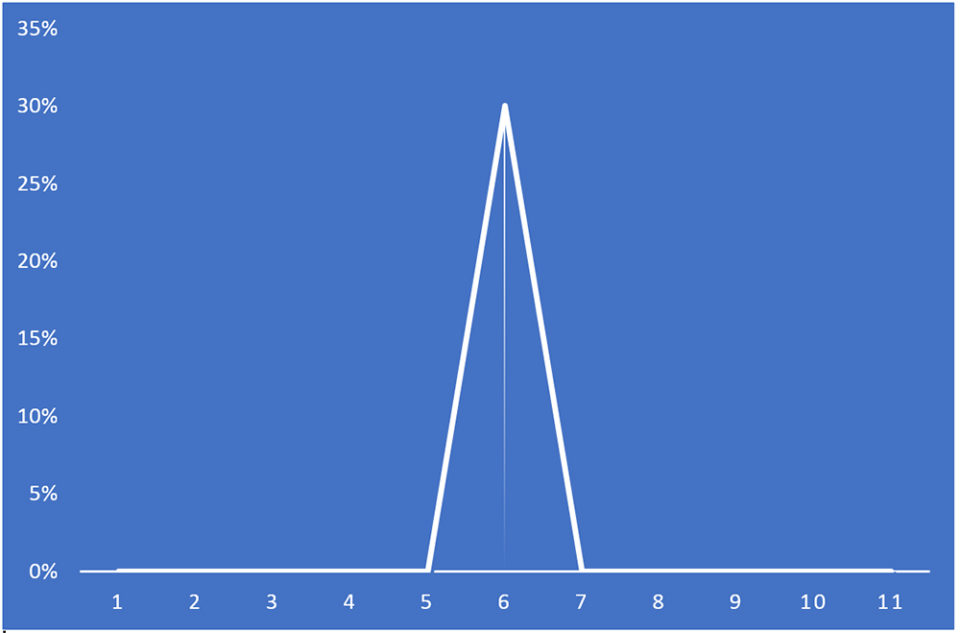
A las pocas horas de la remediación, la mortalidad de PL disminuyó a menos de la detección por observación visual. El personal no observó más mortalidad de PL al día siguiente o después. Cinco días después del inicio de la enfermedad, se cosecharon los cinco tanques. Las PL en todos los tanques parecían robustas y activas. La supervivencia de la cosecha fue del 70 por ciento para el tanque afectado por AHPND y la supervivencia media ± desviación estándar fue de 83.5 ± 0.027 por ciento para los cuatro tanques de pre-cría no afectados (Fig. 1).
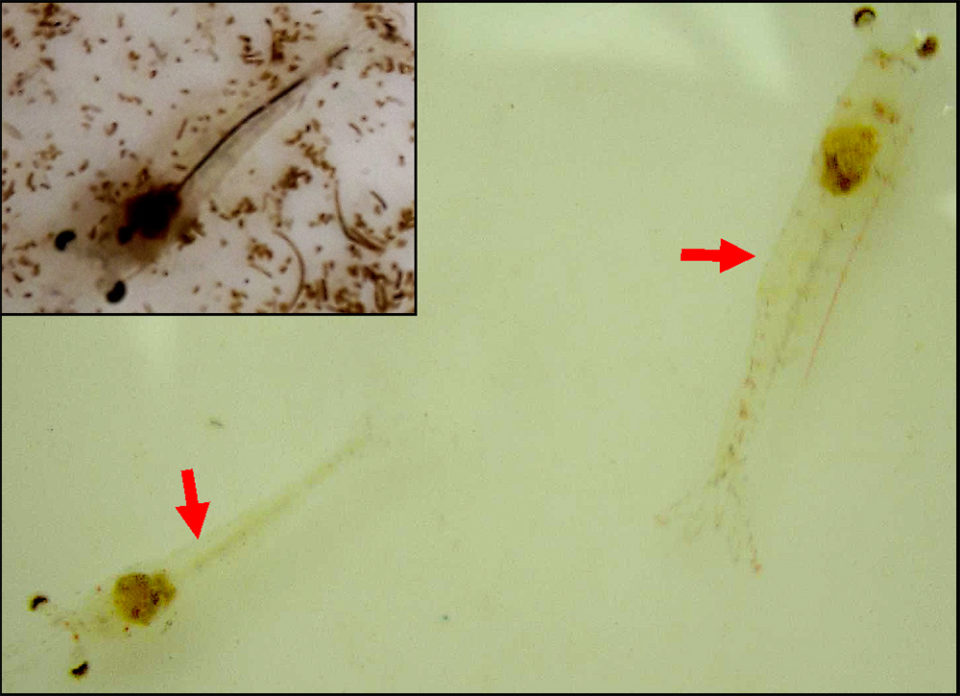
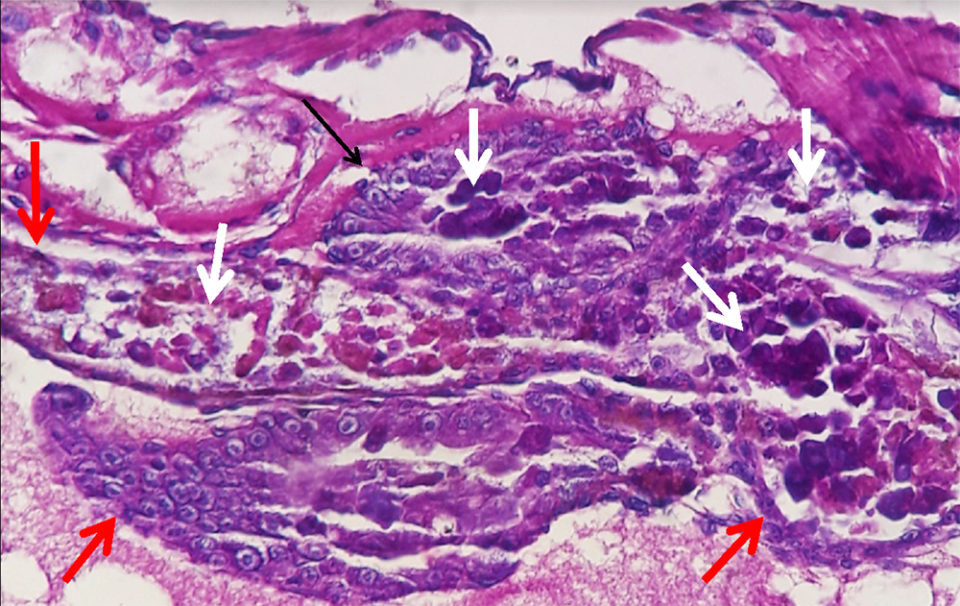

Resultados del análisis de laboratorio y discusión
El informe del laboratorio indicó que tanto el PCR AP4 como las pruebas histopatológicas fueron positivas para AHPND. No hubo otros hallazgos de laboratorio significativos.
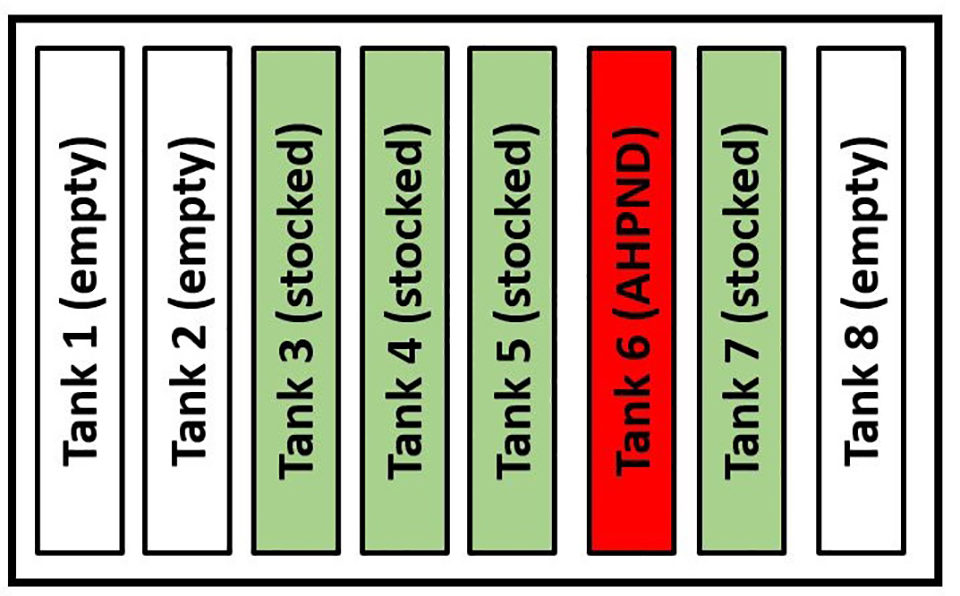
El Diagrama 1 muestra la disposición física de los ocho tanques en la pre-cría y la ubicación del tanque 6 en relación con los otros tanques. El tanque 6 fue el único tanque impactado por AHPND. Debido a que el AHPND solo comprometió un tanque y no los otros cuatro tanques, que se sembraron y mantuvieron utilizando los Procedimientos de Operación Estándar (SOP) de la instalación, el patrón de ataque reveló que los factores predisponentes que contribuyeron al brote de AHPND en el tanque 6 fueron aislados a un tanque
Además, es improbable que los factores comunes a todos los tanques (calidad del agua entrante, calidad de PL cuando se sembraron los tanques, la calidad de los alimentos aplicados a todos los tanques de PL, etc.) nutrieron la aparición del AHPND, sino más bien el factor iniciador se limitó solo al tanque 6. En nuestra opinión, el factor desencadenante fue la sobre-alimentación accidental la noche previa al inicio del AHPND en el tanque 6. Como uno de nosotros (JAB) y co-autores informaron en 2015, el alimento no consumido fue colonizado por AHPNDVp y en aproximadamente 4 horas de incubación, la alimentación contaminada presentó un riesgo de riesgo significativo (AHPND) para los camarones que ingirieron los alimentos colonizados y contaminados con toxinas Pir A/B.
Abajo se enumeran los sustratos que se sabe que soportan el rápido crecimiento y la excreción de las altamente nocivas toxinas Pir A/B por AHPNDVp.
Ejemplos de sustratos que promueven la excreción de AHPNDVp de toxinas Pir A/B
- Medio de caldo microbiológico denso en nutrientes.
- Fertilizantes orgánicos, melaza, exceso de alimento de camarón, etc. aplicados antes o después de la siembra del camarón.
- Alimento de camarón sin consumir y/o los sedimentos ricos en nutrientes en estanques y tanques.
- Cadáveres de camarones.
Además, los datos de la curva de mortalidad respaldan la interpretación de que las toxinas Pir A/B se elaboraron y acumularon en el alimento no consumido y en los sedimentos orgánicos del fondo del tanque. Nuestra hipótesis es que durante la noche las PL ingirieron alimentos no consumidos y/o desperdicios del fondo y al hacerlo, consumieron abundantes bacterias + niveles dañinos de toxinas Pir A/B.
Los genes de la toxina Pir parecen estar regulados positivamente cuando las bacterias toxigénicas Pir A/B encuentran condiciones ambientales y de nutrientes que apoyarán la rápida multiplicación de las bacterias y proporcionan las condiciones adecuadas para la detección del quórum y la producción de toxinas Pir A/B. Enumeramos ejemplos arriba que creemos que son sustratos adecuados que promueven la formación y la excreción de estas toxinas.
Pasos rápidos de respuesta a un brote de AHPND en un tanque de pre-cría de camarones con fondo revestido
- ¡Esta es una emergencia de salud animal! Una vez reconocida, la respuesta inmediata es esencial.
- Si es necesario, baje el nivel del agua en el tanque hasta que el fondo del tanque esté claramente visible. Continúe con el reemplazo de agua si el agua entrante no tiene una turbidez significativa.
- Comience con el sifón para eliminar los restos de detritus y los restos de camarones.
- Detenga la aplicación de alimento y reduzca la intensidad de aireación para permitir que se asiente el material suspendido. Tan rápido como sea posible, use el sifón en el fondo del tanque para eliminar el detritus acumulado y todos los cadáveres de camarones.
- Recolecte las muestras de camarón sintomático en un fijador de tejidos apropiado para las pruebas de laboratorio para confirmar o no que la causa es AHPND. Recoja las muestras de camarón de los detritos sifonados. Los cadáveres de camarones se pueden usar como muestras para la prueba de PCR para AHPND.
- Inspeccione el tanque cada hora y evalúe el estado. Reanude la aplicación de alimento cada hora, pero aplíquelo con cuidado y reduzca la cantidad de alimento si aún hay alimento no consumido en el tanque.
- Sifonée el fondo del tanque dos veces al día, o con mayor frecuencia si es necesario.
- Después de tres a cinco días, reanude los SOP estándar para el manejo del tanque de pre-cría.
- En regiones donde el AHPND es nativo, siempre tenga en cuenta el peligro de acumular detritus en los tanques de pre-cría de camarones y, si no es parte de los SOP de sanitización de tanques, considere una mejora a la inspección diaria o más frecuente del fondo del tanque y la extracción con sifón del detritus y sedimentos acumulados.
La ingestión de toxinas Pir A / B causó necrosis y exudado del epitelio del túbulo del hepatopáncreas expuesto. Los desechos celulares proporcionaron un ambiente rico en nutrientes que se combinó con una alta densidad de V. parahaemolyticus y, presumiblemente, otros Vibrio spp., en cascada hacia una enfermedad potencialmente mortal para el camarón envenenado por Pir A / B. Recientemente, se confirmó que un evento grave de enfermedad AHPND con inicio en un criadero en América Latina fue causado por V. owensii utilizando herramientas moleculares (Cuéllar-Anjel, datos no publicados).
Históricamente, la prevención de AHPND fue reconocida por productores progresistas en Tailandia y, quizás, en otros lugares desde 2013 hasta 2014. Los productores progresistas abordaron el problema de AHPND lógicamente y a través de prueba y error descubrieron que las pérdidas de AHPND podrían reducirse significativamente o en gran medida a través de ajustes a la alimentación (pequeña cantidad, aplicado cada pocas horas) junto con la remoción diaria o varias veces por día de residuos del fondo de los raceways, tanques o estanques revestidos.
Si bien el caso reportado aquí demuestra que la detección temprana y la implementación de la respuesta de emergencia apropiada pueden ser efectivas para detener la progresión de una epidemia de AHPND, los autores enfatizan que la prevención es preferible a la intervención de emergencia en el manejo de la enfermedad.
Perspectivas
Este informe de caso destaca que el control de AHPND se puede lograr en tanques de pre-cría por la acción correctiva rápida (barra lateral 3), cuando el inicio de la enfermedad se reconoce temprano.
Para la prevención de AHPND, los autores subrayan la importancia de evitar la sobre-alimentación, y la inspección regular y la eliminación de alimentos no consumidos y otros sedimentos orgánicos suspendidos, de los fondos de tanques o estanques revestidos de pre-cría. El saneamiento del fondo del tanque de pre-cría es una clave para evitar el AHPND en regiones y zonas donde el AHPNDVp es nativo.
Authors
-
Jorge Cuéllar-Anjel, D.V.M., M.Sc., Cert. Aq. Prof.
Aquaculture Veterinarian
Calle 101 # 20-33 Apt. 301
Bogotá, D.C., Colombia -
James A. Brock, D.V.M.
Aquatic Farms
49-239 Kamehameha Hwy.
Kaneohe, Hawaii 96744, USA
Tagged With
Related Posts

Health & Welfare
Cuatro cepas de AHPND identificadas en granjas de camarón de América Latina
Se conocen dos genes de virulencia que codifican una toxina binaria de Photorhabdus relacionada con insectos que causa la enfermedad de necrosis hepatopancreática aguda en camarones. Las patogenicidades de estas cepas de V. campbellii fueron evaluadas mediante infección de laboratorio y posterior examen histológico en camarones P. vannamei.

Responsibility
Acuacultura Brasileña: Limitaciones y desafíos (Parte 1)
La acuacultura ha experimentado su mayor crecimiento en la última década (con un promedio de 8 por ciento por año) en comparación con otras industrias animales, pero todavía está muy por detrás de la producción alcanzada por las industrias avícola, bovina y porcina.

Health & Welfare
Construyendo un mejor pre-criadero de camarones, parte 1
Los sistemas de pre-criadero de camarones ofrecen una oportunidad importante para aumentar los beneficios. Los pre-criaderos adecuadamente diseñados y operados son instalaciones altamente bioseguras para criar postlarvas a densidades muy altas. El objetivo es producir juveniles fuertes, sanos y uniformes con un potencial significativo de crecimiento compensatorio después de su transferencia para el crecimiento final en estanques.

Health & Welfare
Experiencias en el mejoramiento genético del camarón en siete países
En ocho programas de mejora genética de camarón en siete países diferentes, las mejoras en el crecimiento han sido constantes en todos los programas, con tasas de mejoría anual entre 5 y 12 por ciento. Las mejoras en las tasas de supervivencia son menos previsibles y menos consistentes.


