Sistema IMTA de un solo tanque tiene el mejor rendimiento de biorremediación, y la producción de biomasa es la mitad del tamaño operativo que otros diseños

La acuacultura multitrófica integrada (IMTA) es un enfoque basado en ecosistemas donde se integran especies de diferentes niveles tróficos para maximizar la recuperación de los nutrientes introducidos en el sistema de producción. Los nutrientes no utilizados (alimentos y heces no consumidos) derivados de especies alimentadas (por ejemplo, peces y crustáceos) que comúnmente se desperdician a través de los efluentes de las granjas se recuperan en una valiosa biomasa de especies extractivas, al tiempo que se logra la biorremediación de los efluentes.
Las especies acuáticas criadas en agua salada excretan entre el 50 y el 80 por ciento del nitrógeno (N) de su alimento y del 35 al 85 por ciento del fósforo (P) de su alimento, que es un desperdicio y afecta el medio ambiente, ya que los efluentes de las granjas generalmente deben tratarse para cumplir con los requisitos legales. normativas para permitir su liberación al medio acuático. Esta limitación puede superarse si dicho exceso de nutrientes se recupera mediante la biorremediación de los efluentes de la acuacultura de agua salada.
Los modernos sistemas de recirculación acuícola (RAS) han permitido el cultivo de especies de agua salada en todas partes, incluso en lugares alejados de las fuentes de agua marina. Sin embargo, una de las mayores preocupaciones al operar estos sistemas es la gestión y los costos asociados con la reducción / eliminación de las cargas de nutrientes presentes en el agua efluente, ya que los efluentes salinos ricos en nutrientes no pueden descartarse / usarse directamente tierra adentro para evitar la salinización del suelo.
Los nutrientes no utilizados que comúnmente se desperdician en los efluentes acuícolas están compuestos por materia orgánica particulada (POM), materia orgánica disuelta (DOM) [incluyendo nitrógeno orgánico disuelto (DON) y fósforo (DOP)] y como nutrientes inorgánicos disueltos]. La recuperación de nutrientes inorgánicos disueltos se puede lograr utilizando productores primarios como especies extractivas ̶ como microalgas, algas marinas y halófitas [plantas tolerantes a la sal que crecen en suelos o aguas de alta salinidad] ̶ mientras que la recuperación de POM se puede implementar mediante organismos filtradores y otros, como gusanos poliquetos y bivalvos.
Los gusanos poliquetos, como Hediste diversicolor y Arenicola marina, pueden ser especies extractivas clave para recuperar los nutrientes desperdiciados del POM presente en los efluentes acuícolas, mientras que las halófitas como Salicornia ramosissima pueden ser especies extractivas clave para recuperar nutrientes inorgánicos disueltos (principalmente nitrógeno y fósforo) .
Este artículo – adaptado y resumido de la publicación original [Jerónimo, D. et al. 2021. Recovering wasted nutrients from shrimp farming through the combined culture of polychaetes and halophytes. Sci Rep11, 6587 (2021)] – reporta sobre un estudio que evaluó el rendimiento de biorremediación y la producción de biomasa del cultivo combinado de poliquetos y halófitos, a saber, A. marina y S. ramosissima (Amar + Sram) y H. diversicolor y S . ramosissima (Hdiv + Sram) usando el agua efluente de un RAS de camarones operado con agua subterránea salina pretratada (~ 20 ppt de salinidad). Estos diferentes diseños de IMTA se probaron utilizando diferentes áreas operativas, incluido un solo tanque de policultivo (1-T) y como dos niveles tróficos con dos tanques separados (2-T) con 0.3 y 0.6 metros cuadrados de área operativa, respectivamente.
Configuración del estudio
Este estudio se llevó a cabo en RiaSearch Lda., una empresa de investigación en nutrición acuícola ubicada en la laguna costera Ria de Aveiro, Portugal. La compañía utiliza sistemas de recirculación acuícola (RAS) para cultivar camarón blanco del Pacífico (Litopenaeus vannamei) y opera con agua subterránea salobre que se trata previamente mediante oxidación química y filtración rápida de arena para eliminar el hierro. El agua de este sistema se utilizó en los diferentes diseños de acuacultura multitrófica integrada (IMTA) y se utilizaron filtros de arena asistidos por poliquetos (PASF) y halófitas. Todas las especies extractivas probadas en el presente trabajo pueden recolectarse fácilmente y son muy abundantes en el sitio de estudio. En la Figura 1a se muestra una representación esquemática de los diferentes diseños de IMTA probados en el presente estudio.
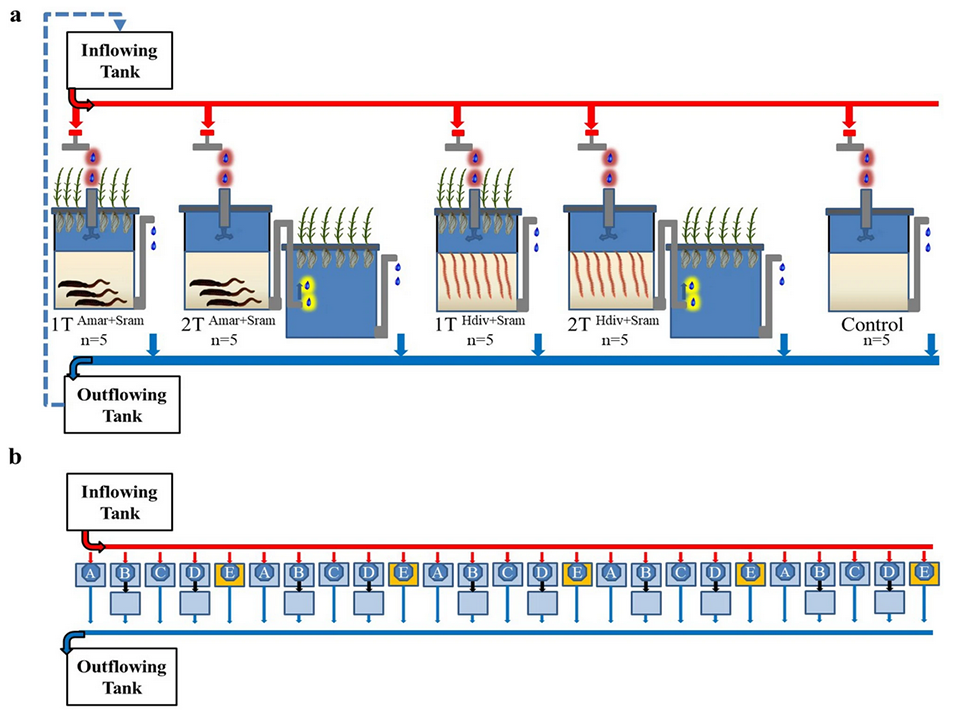
Los diseños 1-TAmar + Sram y 2-TAmar + Sram se sembraron con el poliqueto A. marina y la halófita S. ramosissima, mientras que los diseños 1-T Hdiv + Sram y 2-T Hdiv + Sram se sembraron con el poliqueto H. diversicolor y la halófita S. ramosissima. Diseños con poliquetos y halófitos cultivados 1-T en el mismo tanque (área operativa ≈ 0,3 metros cuadrados), con las raíces de S. ramosissima mantenidas en la columna de agua de las PASF. Los diseños 2-T cultivaron ambas especies extractivas en tanques separados (área operativa ≈ 0,6 metros cuadrados) con el agua que pasa a través del lecho de arena y luego se dirige a la unidad de acuaponía. En los diseños de 1-T, el agua entrante ingresó a los tanques de las PASF a través de una tubería. Cada uno de los cuatro diseños de IMTA realizados en este estudio se evaluó utilizando cinco repeticiones (Fig. 1b). También se incluyeron en el diseño experimental cinco unidades de control sin poliquetos ni halófitas.
Para información detallada sobre el diseño y la configuración experimentales; especies de poliquetos y halófitas utilizados; diseños IMTA; cultivo y seguimiento de especies extractivas IMTA; recolección de datos y determinación de pigmentos fotosintéticos de Salicornia ramosissima; y análisis estadísticos; consulte la publicación original.
Resultados y discusión
Este estudio comparó el desempeño de la biorremediación y la producción de biomasa a través del cultivo combinado de A. marina y S. ramosissima (Amar + Sram) y H. diversicolor y S. ramosissima (Hdiv + Sram) utilizando un solo tanque de policultivo (1-T) y dos niveles tróficos tanques separados (2-T), diseños IMTA con diferentes áreas operativas (0.3 y 0.6 metros cuadrados, respectivamente). El experimento al aire libre mostró una variabilidad significativa para la salinidad y la temperatura del agua (~ 12 a 20 ppt, 16 a 28 ° C, respectivamente), mientras que para el pH y el oxígeno disuelto (OD) se registraron valores más estables (8.1 a 8.4 y 6.8 a 9.5 mg / L, respectivamente). A pesar de la variabilidad, todos estos parámetros se encuentran dentro del rango de valores monitoreados en el agua y las piscinas de agua intermareal de la Laguna Costera de Aveiro, el lugar de recolección de los poliquetos utilizados en nuestro estudio.
Se reportaron eficiencias de biorremediación de 74 a 87 por ciento de POM, 56 a 64 por ciento de nitrógeno inorgánico disuelto (DIN) y 60 a 65 por ciento de fósforo inorgánico disuelto (DIP) del efluente entrante, en diseños de IMTA 1-T y 2-T sembrados con Amar + Sram y Hdiv + Sram. Los filtros de arena asistidos por poliquetos son altamente eficientes en la retención de POM, que se incorpora a la valiosa biomasa extractiva de gusanos.
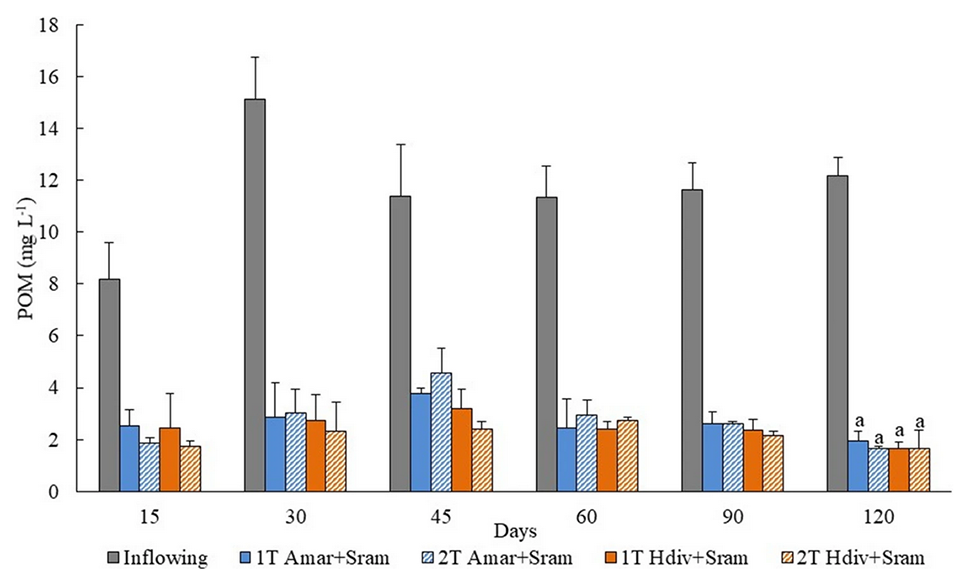
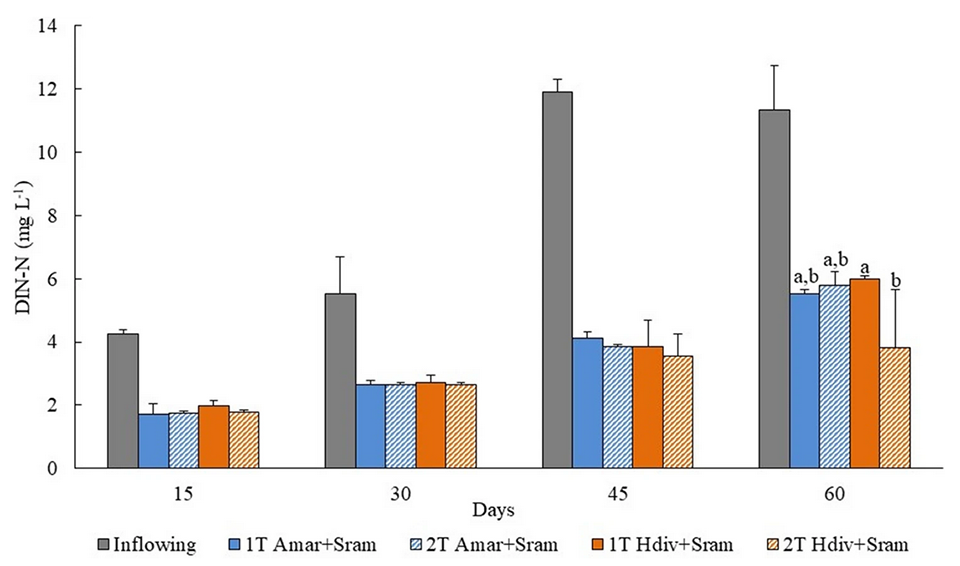
El lecho de arena de los filtros de arena asistidos por poliquetos (PASF) jugó un papel muy importante al retener y mantener la materia orgánica (OM) disponible para sostener el crecimiento de los poliquetos, mientras que estos organismos promovieron la bioturbación (reelaboración de sedimentos y bioirrigación, que permite que el oxígeno disuelto llegue a capas más profundas del sustrato), característica primordial para evitar la obstrucción del sistema y mantener la percolación del agua a través del lecho de arena. Nuestros resultados mostraron claramente este efecto, porque al final del período experimental cada uno de los diseños probados almacenados con poliquetos permanecieron operativos, mientras que los tanques de control estaban obstruidos y el agua se desbordaba.
Se espera que la conversión de POM en biomasa valiosa de lombrices ocurra en PASF, aunque este no fue el caso de los sembrados con A. marina, que tenían mortalidades superiores al 90 por ciento. La biomasa de esta especie de poliquetos fue significativamente menor que la biomasa producida en diseños sembrados con H. diversicolor; sin embargo, estas diferencias resultan de la alta mortalidad reportada en los diseños 1-T y 2-T sembrados con A. marina. Al comparar la biomasa de este poliqueto con la biomasa producida por H. diversicolor, que tiene un ciclo de vida completamente diferente, se debe considerar que en un estudio de 120 días, en el mejor de los casos, solo podríamos comparar la ganancia de biomasa de individuos inicialmente sembrados de A. marina con la ganancia de biomasa resultante de los juveniles de H. diversicolor producidos en el mismo período.
Aunque con frecuencia se reportan temperaturas superiores a 20 grados-C en las piscinas de agua intermareal junto a las poblaciones silvestres de A. marina, los resultados anteriores mostraron que las temperaturas del agua por encima de este umbral pueden haber perjudicado el éxito del cultivo de esta especie de poliquetos. La mortalidad reportada en estudios previos probablemente estuvo relacionada con temperaturas del agua por encima de los valores óptimos, lo que refuerza la necesidad de controlar estrictamente este parámetro cuando se cultiva A. marina al aire libre.
Para H. diversicolor, las condiciones de cultivo utilizadas fueron adecuadas para su desarrollo, siendo las densidades finales registradas en los diseños 1-T y 2-T IMTA aproximadamente 15 veces las densidades de siembra iniciales (densidad final ≈ 4000 a 5000 ind. por metro cuadrado). No se encontraron diferencias significativas entre la biomasa de H. diversicolor (peso fresco) obtenida en los diseños 1-T y 2-T, con valores obtenidos al final más bajos que al inicio del experimento (≈ 77 a 100 vs 130 gramos por cuadrado metro, respectivamente). No obstante, es importante resaltar que los ejemplares al final del experimento correspondían a una población de juveniles recién generada que recién comenzaba a crecer y aún no alcanzaba tamaño comercial.
Con respecto al rendimiento de crecimiento de las halófitas, se reportó un peso promedio significativamente más alto (≈ 2 veces más alto) para las plantas cultivadas bajo el diseño 1-T, independientemente de las especies de poliquetos que se sembraron. La biomasa total reportada en los diseños 1-T y 2-T después de 60 días de prueba experimental fue 5 – 5,7 y 1,7 -2,4 veces mayor que la biomasa almacenada inicialmente, lo que representa productividades de biomasa aérea comestible de ≈ 150 a 170 y 60 a 90 gramos por metro cuadrado, respectivamente. Estos valores fueron más bajos que los estudios informados anteriormente.
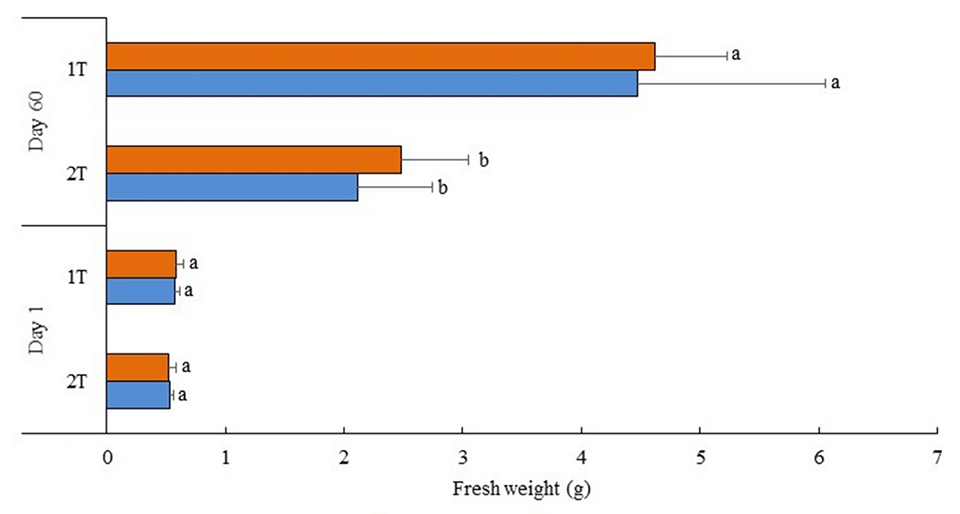
En nuestro estudio, las condiciones de cultivo afectaron el desarrollo de S. ramosissima. Muy temprano en el ensayo, las plantas comenzaron a desarrollar una coloración amarillenta, y algunas incluso exhibieron signos evidentes de senescencia [envejecimiento biológico, el deterioro gradual de las características funcionales]. Al final de nuestro período experimental, aproximadamente del 40 al 60 por ciento de las plantas ya no eran viables, siendo este porcentaje un poco más alto en el diseño 2-T IMTA. El desarrollo de la coloración amarillenta probablemente estuvo relacionado con la falta de hierro, ya que toda el agua salada utilizada en el sistema de cultivo de camarón y el diseño RAS-IMTA se bombeó desde un pozo y se pretrató mediante oxidación química. Este tratamiento favorece la precipitación y eliminación del hierro, junto con otros elementos.
Estos resultados pueden revelar una falta de elementos clave (micronutrientes) para promover el crecimiento de las plantas, como hierro, zinc y calcio, que pueden ser biofortificados a través de fertilizantes. Otra explicación para la coloración amarillenta y la senescencia prematura puede estar asociada con el hecho de que el agua rica en nutrientes empleada en este estudio se almacenó durante tres días en un tanque de reserva sin aireación (una bomba sumergida solo mezclaba el agua cinco minutos cada hora). Estas condiciones pueden haber favorecido la producción de gases tóxicos, como el sulfuro de hidrógeno, que en las plantas afecta la regulación del crecimiento, desarrollo y senescencia de las plantas.
Sin embargo, es importante señalar que las plantas del género Salicornia se encuentran predominantemente en marismas bajas con condiciones anóxicas [falta de oxígeno] y donde los niveles de sulfuro pueden ser altos. Las plantas cultivadas en los diseños IMTA 1-T y 2-T exhibieron un contenido más bajo de pigmentos vegetales como clorofilas y carotenoides totales (≈ 124 a 166, 16 a 26 y 118 a 128 µg / g de peso seco, DW, biomasa, respectivamente) que los registrados cuando fueron sembrados inicialmente, así como en conespecíficos de la naturaleza (≈ 1912 a 1695, 508 a 661 y 625 a 749 µg / g de biomasa de peso muerto, respectivamente). Esta disminución en el contenido de pigmento también puede haber sido causada por el uso de agua de pozo pretratada con oxidación química.
Perspectivas
En general, el diseño experimental 1-T tuvo el mejor desempeño, con productividades de biorremediación y poliquetos similares y la mejor productividad de halófitas. También permitió la reducción a la mitad del área operativa requerida para implementar un marco IMTA utilizando estas especies extractivas.
Nuestros resultados también mostraron las limitaciones significativas inherentes al cultivo de ciertas especies extractivas al aire libre, por ejemplo, cuando las condiciones abióticas clave como la temperatura del agua son difíciles de controlar. En nuestro estudio, la incapacidad para controlar este parámetro puede haber perjudicado el cultivo exitoso de A. marina.
Por otro lado, nuestro estudio también mostró que los efluentes de los sistemas de cultivo que utilizan agua subterránea salobre que ha sido tratada para eliminar el hierro mediante oxidación química y filtración rápida de arena pueden afectar el uso de algunas especies extractivas para IMTA. De hecho, la falta de hierro (y eventualmente también de otros oligoelementos eliminados durante la oxidación química y la rápida filtración de arena) puede ser un cuello de botella que perjudique la producción exitosa de S. ramosissima y otras valiosas plantas halófitas.
Ahora que Ud. ha terminado de leer el artículo…
… Esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola mundial y compartir el conocimiento expansivo de nuestra amplia red de colaboradores cada semana.
Al hacerse miembro de la Alianza Global de Acuacultura, se asegura de que todo el trabajo precompetitivo que hacemos a través de los beneficios, recursos y eventos para miembros pueda continuar. La membresía individual cuesta solo US$50 al año. Los miembros individuales y corporativos de GAA reciben acceso gratuito a una serie de eventos virtuales GOAL a partir de abril. Únase ahora.
¿No es Ud. miembro de la GAA? Únase a nosotros.
Authors
-
Daniel Jerónimo, M.Sc.
Corresponding author and Ph.D. student
ECOMARE and CESAM and Departamento de Biologia, Universidade de Aveiro, Campus Universitário de Santiago, 3810-193, Aveiro, Portugal -
Ana Isabel Lillebø, Ph.D.
ECOMARE and CESAM and Departamento de Biologia
Universidade de Aveiro, Campus Universitário de Santiago, 3810-193, Aveiro, Portugal -
Javier Cremades, Ph.D.
Coastal Biology Research Group (BioCost)
Facultad de Ciencias and CICA, Universidade da Coruña, 15071, A Coruña, Spain -
Paulo Cartaxana, Ph.D.
ECOMARE and CESAM and Departamento de Biologia
Universidade de Aveiro, Campus Universitário de Santiago, 3810-193, Aveiro, Portugal -
Ricardo Calado, Ph.D.
ECOMARE and CESAM and Departamento de Biologia
Universidade de Aveiro, Campus Universitário de Santiago, 3810-193, Aveiro, Portugal
Tagged With
Related Posts

Innovation & Investment
Puesta a punto: convirtiendo aguas residuales de la acuacultura en combustible de aviación
El Sistema de Energía y Agricultura de Agua de Mar en la Universidad Khalifa en Masdar City, EAU, está aplicando conceptos de acuacultura a la producción de biocombustibles para las aerolíneas.

Health & Welfare
Temas de producción actuales en la cría de camarones, parte 2
La implementación efectiva de los protocolos de bioseguridad en el cultivo de camarón requiere conocimiento, disciplina y el compromiso de los propietarios y gerentes de granjas para implementarlos. Los autores consideran los viveros y precrías intensivas y cómo excluir a los patógenos, depredadores y competidores.

Aquafeeds
Algas cultivadas en estanques: ¿Superhéroe viscoso para alimentos acuícolas?
Qualitas Health, que cultiva algas en estanques en Nuevo México y Texas para suplementos humanos, está ingresando al mercado de ingredientes de alimentos acuícolas alternativos.

Health & Welfare
Las prácticas de bioseguridad en las granjas de peces necesitan reforzarse
Las medidas de bioseguridad y las estrategias preventivas son esenciales en cualquier cadena de producción biológica. Los programas de bioseguridad adecuadamente planificados e implementados mejorarán la sanidad animal, la producción y la economía.


