El crecimiento comercial simulado refuerza el valor de la selección basada en la filtración de reproductores libres o de bajo nivel de IHHNV, el uso de poblaciones SPF y la selección de resistencia/tolerancia a IHHNV
El virus de la necrosis hipodérmica y hematopoyética infecciosa (IHHNV) se identificó por primera vez en 1983 en las Américas como la causa de la mortalidad en masa de camarones azules del Pacífico (Litopenaeus stylirostris) cultivados. Poco después, también se identificó que causaba deformidades en la cáscara y un retraso en el crecimiento conocido como “síndrome de deformidad de enanos” en camarones blancos del Pacífico (Litopenaeus vannamei) cultivados.
En Australia y en otras partes del Indo-Pacífico, el IHHNV se detecta comúnmente en una alta prevalencia en el camarón tigre negro (Penaeus monodon) silvestre y de cultivo. Si bien se ha considerado que la infección por IHHNV es relativamente benigna y de poca importancia para la acuacultura de esta especie, se infirió que la infección aguda era la causa de deformidades severas de la concha en una cohorte de la Generación 3 domesticada de P. monodon en Indonesia a principios de los años noventa.
La detección de IHHNV basada en la PCR se ha complicado por la variación de la secuencia del genoma entre las cepas de sus tres linajes conocidos (I, II y III) y por formas del genoma IHHNV no infecciosas que se han integrado en el ADN cromosómico de algunos P. monodon en poblaciones ampliamente dispersas en su rango de distribución natural.
Para evitar la detección cruzada de formas del genoma de IHHNV integrado, las pruebas de PCR convencionales y en tiempo real se han diseñado para o excluir su amplificación o detectar específicamente el elemento viral endógeno integrado de IHHNV en la exclusión de las infecciones de los linajes IHHNV. Las pruebas de PCR(q) cuantitativas en tiempo real para IHHNV también proporcionan un medio para cuantificar con precisión las cantidades de ADN de IHHNV como una medida de las cargas de infección relativas.
Este artículo resume los resultados de un estudio (https://doi.org/10.1016/j.aquaculture.2018.09.032) que fue un ensayo de crecimiento de dos cohortes de P. monodon que difirieron en su prevalencia de IHHNV y las cargas resultantes de las infecciones por IHHNV que difirieron sustancialmente entre los reproductores hembras de las que se derivaron. Los camarones fueron criados bajo condiciones comerciales simuladas en cuatro estanques de investigación de 0.16 hectáreas. Se utilizó la qPCR en tiempo real para rastrear la carga y la prevalencia de IHHNV entre grupos de 48 camarones muestreados a intervalos regulares durante el crecimiento de cada uno de los cuatro estanques. Estos datos identificaron una asociación clara entre el inicio temprano de la infección por IHHNV de alto nivel y las tasas de crecimiento, supervivencia y rendimiento de la cosecha sustancialmente reducidas.
Esta investigación fue financiada financieramente por la Corporación de Investigación y Desarrollo Pesqueros (FRDC), la Asociación de Productores de Langostinos de Australia (APFA), el Fondo de Dotación de Ciencia e Industria (SIEF) y CSIRO y se detalla en el Informe Final del Proyecto FRDC (2015-240 APFA IPA) ISBN 978–0–646-98,999-0. Agradecemos a las muchas personas que apoyaron el proyecto de diferentes maneras y a Ridley Aqua Feed por contribuir a los costos de alimentos de camarón.
Configuración de prueba de crecimiento
Reproductores de Penaeus monodon capturados en aguas costeras cerca de la Playa Bramston en el norte de Queensland fueron transportados por aire al Centro de Investigación de la Isla Bribie dentro de las 48 horas posteriores a la captura. Al recibirlos, cada camarón fue sexado, pesado, etiquetado en el ojo y un pedazo de tejido de pleópodo preservado para el análisis de PCR. Cada uno de los tanques de maduración circular de 2 x 10.000 litros se sembró con 32 hembras y 32 machos. Los tanques estaban en una habitación oscura, con tapas reductoras de luz, tenían un lecho de arena de 3 mm y fueron surtidos con un flujo de agua de mar calentada y suficiente aireación para mantener niveles óptimos de oxígeno disuelto. Los reproductores fueron alimentados con diversos alimentos naturales típicos de los utilizados en los criaderos comerciales locales para promover la fecundidad. Se tomó una muestra de tejido de pleópodo adicional de cada hembra en los momentos en que se le realizó una ablación visual y cuando desovo.
Los huevos desovados por las hembras se criaron en tanques hasta la etapa postlarval 20 (PL20) usando procedimientos estándar de incubación. Los grupos de PL20 que se originaron o de un grupo de tres hembras o de un grupo de cuatro hembras se sembraron en dos estanques replicados cubiertos de plástico y cubiertos con red de aves (40 m × 40 m x 2 m de profundidad; 0.16 ha) y se criaron utilizando prácticas comerciales estándar locales. Se tomaron muestras de grupos de 144 camarones de cada uno de los cuatro estanques a intervalos regulares durante el crecimiento para registrar los pesos y el sexo y para preservar el tejido de los pleópodos y/o los órganos linfoides (LO) para su posterior análisis por PCR. Los camarones se cosecharon mediante redes y, finalmente al drenar los estanques entre 150 y 170 días de cultivo (DOC) para determinar los rendimientos finales de estanque y las tasas de supervivencia de los camarones.

Por favor refiérase a Sellers et al. (2019) (https://doi.org/10.1016/j.aquaculture.2018.09.032) para obtener información más detallada sobre los métodos de maduración y desove de los reproductores, la cría de larvas, los métodos de conteo de PL y de almacenamiento en estanques, el cultivo y el muestreo de camarones. métodos, así como extracción de TNA, síntesis de cDNA y TaqMan en tiempo real de pruebas de qPCR y análisis estadísticos de datos.
Diferencias de rendimiento y supervivencia en estanques
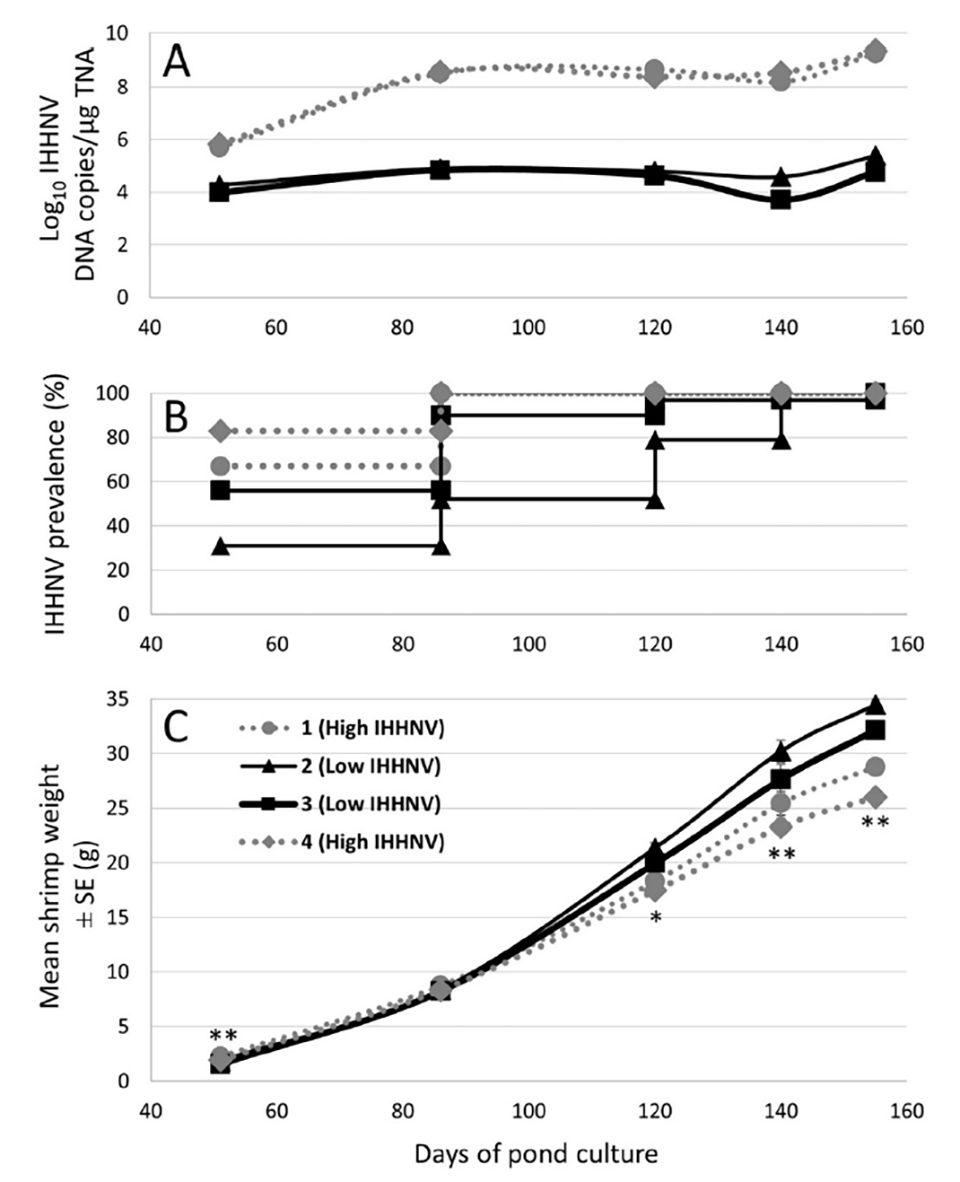
Los pesos de 144 P. monodon recolectados al azar de cada uno de los 4 estanques de investigación de 0,16-ha c/u se rastrearon a intervalos regulares durante el crecimiento. Desde los 120 días de cultivo (DOC) en adelante, los pesos fueron significativamente más bajos entre los camarones de la cohorte sembrada en 2 de los 4 estanques (es decir, los estanques 1 y 4; Fig. 1). La apariencia general de los camarones recolectados de estos dos estanques a partir de este punto de tiempo en adelante también se redujo notablemente en comparación con los recolectados en los estanques 2 y 3.
Los camarones se cosecharon progresivamente durante un período de dos semanas a partir de los 155 DOC. Para cuantificar las diferencias a escala comercial, se determinó el rendimiento final de la cosecha en cada estanque de investigación de 0,16 ha y se extrapolaron (x 6,25) a un estanque comercial típico de 1-ha. Usando estos datos, los rendimientos de los estanques 2 y 3 (12.3 y 14.2 toneladas, respectivamente) fueron 22 por ciento a 58 por ciento más altos que los rendimientos de los estanques 1 y 4 (9.0 y 10.1 toneladas, respectivamente) (Tabla 1). Con base en los pesos promedio determinados para el camarón cosechado, la supervivencia estimada en los estanques 2 y 3 (95.9 por ciento y 99.8 por ciento, respectivamente) también fue 13 por ciento a 25 por ciento más alta que en los estanques 1 y 4 (79.9 por ciento y 84.5 por ciento, respectivamente) . Como resultado de la mayor tasa de crecimiento y la supervivencia de la cohorte de camarón criada en los estanques 2 y 3, colectivamente consumieron 36 por ciento más alimento que la cohorte criada en los estanques 1 y 4.
Sellars, IHHNV, Tabla 1
| Estanque No. | Grupo IHHNV | Alimento consumido (kg) | Peso de cosecha (kg) | Factor de conversión de alimento (FCR) | Rendimiento (TM/ha*) | Supervivencia (%) |
|---|
Estanque No. | Grupo IHHNV | Alimento consumido (kg) | Peso de cosecha (kg) | Factor de conversión de alimento (FCR) | Rendimiento (TM/ha*) | Supervivencia (%) |
|---|---|---|---|---|---|---|
| 2 | IHHNV-bajo | 3,245 | 2,273 | 1.43 | 14.2 | 95.9 |
| 3 | IHHNV-bajo | 3,337 | 1,996 | 1.70 | 12.3 | 99.8 |
| 1 | IHHNV-alto | 2,434 | 1,613 | 1.51 | 10.1 | 84.5 |
| 4 | IHHNV-alto | 2,388 | 1,436 | 1.66 | 9.0 | 79.9 |
* extrapolado del estanque de 0.16 ha (es decir, peso total / 0.16)
Usando los números extrapolados, los estanques 2 y 3 produjeron colectivamente 7,44 toneladas (avg. = 3,72 toneladas / ha) más camarones que los estanques 1 y 4. Como estos camarones tenían un peso medio de cosecha que resultó en 35 a 38 piezas / kg con un valor cocido al por mayor. en Australia de aproximadamente AUD$ 8 / kg, este rendimiento adicional de 3.72 ton / ha mejoraría el valor bruto del cultivo (sin considerar los costos adicionales de alimentación, cocción y accesorios) en aproximadamente AUD$ 67,000 por estanque de 1 ha.
Diferencias de carga de infecciones de IHHNV
Las pruebas de qPCR en tiempo real de TaqMan identificaron la ausencia de virus asociado a las branquias [GAV; genotipo 2 del virus de la cabeza amarilla (YHV2)] o del genotipo 7 del virus de la cabeza amarilla (YHV7) en los reproductores y sus cohortes de progenie criados en los cuatro estanques. Por lo tanto, se realizaron pruebas similares para determinar si la infección por IHHNV podría haber sido la causa del rendimiento reducido del crecimiento de la cohorte de camarón criada en los estanques 1 y 4.
Se analizaron las cantidades normalizadas de TNA mediante PCR cuantitativa (q) en tiempo real de TaqMan para comparar directamente las cargas de ADN de IHHNV (como una medida de factode la carga / gravedad de la infección) en todas las muestras. Los datos de qPCR sobre el tejido de los pleópodos muestreados en el momento en que se recibieron los reproductores del norte de Queensland identificaron cargas de IHHNV extremadamente bajas en cinco y cargas sustancialmente más altas en una hembra de cada grupo que contribuyo con la progenie almacenada en los estanques 1 y 4 o los estanques 2 y 3. La carga más alta (6,71 x 105copias de ADN de IHHNV / µg de TNA) fue detectada en 1 de las 3 hembras que contribuyeron con la progenie de los estanques 1 y 4.
Las cargas de IHHNV generalmente aumentaron durante el período de ~ 6 semanas en que los reproductores fueron madurados, ablacionados del pedúnculo ocular y desovados. Sin embargo, las cargas aumentaron a los niveles más altos en las tres hembras que contribuyeron a la progenie de los estanques 1 y 4, con la hembra más alta 100 veces más alta que la más alta de las cuatro hembras que contribuyen a la progenie de los estanques 2 y 3. La prueba de los grupos de huevos identificó que las cargas de IHHNV eran las más altas, y > 100 veces más altas que en los huevos de cualquier otra hembra, en el grupo recolectado de la hembra identificada como poseedora de las cargas más altas de IHHNV cuando se tomaron muestras tanto al llegar como al momento en que desovaron.
También se utilizó la qPCR en tiempo real para detectar y cuantificar las cargas de IHHNV en los pleópodos de 48 de los 142 a 144 camarones individuales recolectados y pesados de cada uno de los cuatro estanques a los 51, 86, 120 y 155 DOC, así como de 30 camarones muestreados de cada estanque a los 140 DOC (Fig. 1). Entre los camarones analizados en estos momentos en los estanques 1 y 4, el IHHNV fue detectado con una prevalencia del 100 por ciento a partir de los 86 DOC. En contraste, entre los camarones analizados en los estanques 2 y 3 al mismo tiempo, la prevalencia de IHHNV fue menor en los puntos iniciales de muestreo y solo alcanzó el 100 por ciento en los tiempos de muestreo (140-155 DOC) muy avanzado ya en el periodo de engorde. Las cargas medias de IHHNV fueron del orden de 100 veces más altas en los estanques 1 y 4 en comparación con los estanques 2 y 3 en el punto de tiempo de muestreo inicial (51 DOC), y más de 1000 veces más altas en los cuatro puntos de tiempo de muestreo posteriores (Fig. 1).
Conclusiones y consecuencias
En general, se ha observado que la infección por IHHNV es relativamente benigna en la producción acuícola de camarón tigre negro (Penaeus monodon). A pesar de esta premisa general, aquí se describen los resultados que muestran que la infección por IHHNV en esta especie debe considerarse más seriamente de lo que se pensaba anteriormente. En circunstancias en las que los camarones estaban sobrecargados por una carga de infección sostenida muy alta, se encontró que el IHHNV era capaz de comprometer profundamente el crecimiento, la salud general, la supervivencia y los rendimientos de cosecha en estanques. Como el monto de las pérdidas de rendimiento se estima en AUD$ 67,000 brutos para un estanque comercial de 1-ha, vale la pena considerar las medidas que evitan que aparezcan tales infecciones.
Con respecto a qué intervenciones podrían ofrecer los medios más efectivos para restringir la ocurrencia de las infecciones de alta carga, se observó que una de las siete hembras reproductoras utilizadas que tenía la mayor carga IHHNV preexistente en el momento de la captura de la naturaleza también tenía la mayor carga en el tiempo en que fue ablacionada y desovada.
Mas aun, los huevos producidos a partir de esta hembra tenían IHHNV a cargas (2,3 x 105 copias de ADN de IHHNNV/µg de TNA) masivamente mayores que cualquiera de las otras seis hembras (30 a 1030 copias de ADN de IHHNVV/μg de TNA), independientemente del hecho de que las cargas de IHHNV también habían aumentado de forma moderada a masiva en estas hembras durante el período de seis semanas, entre el momento en que se recibieron y se desovaron. Por lo tanto, en los casos en que el IHHNV es altamente prevalente en reproductores silvestres capturados para su uso en criaderos, y existen capacidades para cuantificar la gravedad de la infección por qPCR, dichas pruebas deben usarse como un medio para identificar y sacrificar a estas hembras de alta carga antes de que sean condicionadas y desovadas. El filtrado por qPCR de los grupos de huevos para identificar y eliminar a cualquiera con altas cargas de IHHNV también se debe considerar en tales circunstancias para garantizar que solo se cultiven semillas libres de, o de bajo IHHNV.
Existen oportunidades para las estrategias de interferencia de ARN (ARNi) para reducir las cargas de infecciones virales preexistentes y, por lo tanto, la propensión a que las infecciones se transmitan verticalmente a la progenie. Sin embargo, esta tecnología aún tiene que madurar hasta el punto de proporcionar una solución a corto plazo, excepto posiblemente para ayudar a eliminar las infecciones de baja carga de las líneas de reproducción domesticadas de P. monodon. Tales líneas de reproducción libres de patógenos específicos (SPF) de P. monodon proporcionarían la solución, con líneas también seleccionadas para una mejor resistencia / tolerancia a IHHNV, proporcionando una solución aún más ideal.
Sin embargo, en países como Australia, donde las regulaciones de cuarentena prohíben estrictamente la importación de camarón vivo para propósitos de acuacultura, los esfuerzos para generar y perpetuar tales líneas de reproducción no han podido romper el ciclo de dependencia en los reproductores capturados en el medio silvestre. A pesar de algunos avances, hasta que se puedan establecer o adquirir dichas líneas de SPF, la selección basada en el cribado seguirá siendo el único medio para evitar que el IHHNV cause impactos de producción en P. monodon cultivado en Australia y en otros lugares con los mismos problemas.
Datos complementarios a este artículo se pueden encontrar en línea en https://doi.org/10.1016/j.aquaculture.2018.09.032.
Referencias disponibles del primer autor o de la publicación original.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de la acuacultura global y compartir nuestra vasta red en expansión de los conocimientos de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se está asegurando de que todo el trabajo pre-competitivo que realizamos a través de los beneficios a los miembros, recursos y eventos (La Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo US$50 al año.
Authors
-

Melony J. Sellars, Ph.D.
Autor de correspondencia
Queensland Bioscience Precinct
306 Carmody Road
St. Lucia, QLD 4067, Australia -
Jeff A. Cowley, Ph.D.
Queensland Bioscience Precinct
306 Carmody Road
St. Lucia, QLD 4067, Australia -
Dean Musson
Bribie Island Research Centre
144 North Street
Woorim, QLD 4507, Australia -
Min Rao
Queensland Bioscience Precinct
306 Carmody Road
St. Lucia, QLD 4067, Australia -
M.L. Menzies
Queensland Bioscience Precinct
306 Carmody Road
St. Lucia, QLD 4067, Australia -
Greg J. Coman, Ph.D.
Bribie Island Research Centre
144 North Street
Woorim, QLD 4507, Australia -
Brian S. Murphy
Bribie Island Research Centre
144 North Street
Woorim, QLD 4507, Australia
Tagged With
Related Posts

Health & Welfare
Acuamimetismo: Un concepto revolucionario para el cultivo de camarón
El acuamimetismo simula las condiciones de producción naturales estuarinas mediante la creación de floraciones de zooplancton como nutrición suplementaria para los camarones cultivados, y bacterias beneficiosas para mantener la calidad del agua. Se pueden producir camarones de mejor calidad a un costo menor y de manera más sostenible.

Health & Welfare
Enfermedad emergente: el Virus Iridiscente de Hemocitos de Camarón (SHIV)
SHIV es un nuevo virus del camarón blanco del Pacífico en la familia Iridoviridae. Los autores también desarrollaron un ensayo ISH y un método de PCR anidado para su detección específica.

Innovation & Investment
Liberando el potencial genético del camarón tigre negro
El camarón tigre negro es la segunda especie de camarón cultivado a nivel mundial. Debido a su importancia en Australia, el nuevo Centro ARC para Reproducción Avanzada de Camarones desarrollará un programa de cría escalable y avanzado para la especie, y llevará su conocimiento genético a un nivel comparable al de la ganadería.

Aquafeeds
El correcto manejo de los alimentos comerciales para camarón, parte 1
Los sistemas de producción de camarón y su manejo de alimentos deben ser considerados juntos. Esto requiere una comprensión de los aspectos biológicos de las especies objetivo y de su edad, del sistema de producción utilizado, de los procesos químicos y biológicos que controlan el agua y la calidad del fondo, y del monitoreo continuo del sistema y la retroalimentación para proporcionar insumos y ajustes apropiados y oportunos.


