Detección por histopatología, y por nuevos métodos de hibridación in situ y PCR
Los microsporidios son parásitos intracelulares obligados en una variedad de huéspedes, desde invertebrados hasta humanos. La investigación de microsporidios se ha centrado más en hospedadores terrestres, pero aproximadamente el 50 por ciento de los géneros conocidos de microsporidios infectan hospedadores acuáticos como crustáceos y peces. Estas infecciones microsporidianas de huéspedes acuáticos se consideran un peligro potencial para la salud, así como un riesgo financiero en la acuacultura.
Una de las enfermedades críticas que afectan el cultivo del camarón es la “enfermedad de algodón del camarón” (CSD), y los agentes causantes asociados con esta enfermedad son los microsporidios que se encuentran en al menos cinco géneros, incluidos Pleistophora, Thelohania, Perezia, Agmasoma y Ameson. Estos parásitos microsporidianos infectan principalmente el músculo esquelético, haciendo que las regiones del cuerpo afectadas sean blancas u opacas, lo que le da el nombre común a esta enfermedad. Los camarones ligeramente infectados pueden verse y comportarse normalmente, pero las infecciones graves hacen que los camarones no sean comercializables o no sean comestibles. En los camarones, el aspecto blanco opaco del músculo está relacionado principalmente con infecciones microsporidianas. Sin embargo, otros agentes causales como los dinoflagelados, las bacterias o los virus también pueden estar relacionados con esta enfermedad.
Este estudio se centró en el microsporidio asociado con CSD en camarones recolectados de Madagascar, Mozambique y el Reino de Arabia Saudita. Investigamos sus características histopatológicas y determinamos su clasificación taxonómica por secuenciación de subunidades pequeñas de rADN (SSU de rADN). Estas secuencias se usan ampliamente para dilucidar las relaciones evolutivas entre organismos, ya que son de origen antiguo y se encuentran en todas las formas de vida conocidas.
Además, se desarrollaron métodos de diagnóstico específicos para esta enfermedad basados en: 1. hibridación in situ [ISH; un tipo de hibridación usando una cadena marcada complementaria de ADN, ARN o ácidos nucleicos modificados (es decir, sonda) para localizar una secuencia específica de ADN o ARN en una porción o sección de tejido]; y 2. reacción en cadena de la polimerasa (PCR), un método ampliamente empleado en biología molecular para hacer numerosas copias de un segmento de ADN específico) dirigido a la secuencia de SSU de rADN.
Configuración del estudio
Un total de 298 muestras de camarones con signos clínicos de CSD fueron enviadas desde Madagascar, Mozambique y Arabia Saudita Laboratorio de Patología Acuícola de la Universidad de Arizona durante un período de varios años. La Tabla 1 resume la información relevante.
Han, CSD, Tabla 1
| País y especies | Estadío | Grado | Órgano objetivo | No. muestras positivas/totales | PCR |
|---|
País y especies | Estadío | Grado | Órgano objetivo | No. muestras positivas/totales | PCR |
|---|---|---|---|---|---|
| Madagascar (P. monodon) | Adult | G3-G4 | Músculo | 3/3 | NA |
| Madagascar (P. monodon) | Juvenil | G3-G4 | Músculo/HP | 6/30 | NA |
| Madagascar (P. monodon) | Sub-adulto | NA | Músculo/HP | NA | pos. |
| Madagascar (P. monodon) | Sub-adulto | G3-G4 | Músculo/HP | 4/19 | NA |
| Madagascar (P. monodon) | Adulto | G2-G3 | Músculo /HP/corazón | 3/5 | NA |
| Madagascar (P. monodon) | Sub-adulto | G1-G3 | Músculo/HP | 6/28 | NA |
| Madagascar (P. monodon) | Juvenil | NA | Músculo | NA | pos. |
| Madagascar (P. monodon) | Juvenil | G3-G4 | Músculo/HP | 35/35 | NA |
| Madagascar (P. monodon) | Juvenil | NA | Músculo/HP | NA | pos. |
| Mozambique (P. monodon) | Juvenil | G3-G4 | G3-G4 Músculo /HP/agallas/ corazón/LO | 4/23 | NA |
| Mozambique (P. monodon) | PL | G3-G4 | G3-G4 Músculo /HP/agallas/ corazón/LO | 2/50 | NA |
| Mozambique (P. monodon) | Adulto | G3-G4 | G3-G4 Músculo /HP/agallas/ corazón/LO | 4/4 | NA |
| Saudi Arabia (P. indicus) | Adulto | G4 | G3-G4 Músculo /HP/agallas/ corazón/LO | 3/3 | NA |
| Saudi Arabia (P. indicus) | Adulto | G2-G4 | Músculo/HP | 30/93 | NA |
| Saudi Arabia (P. indicus) | Adulto | NA | Músculo | NA | pos. |
| Saudi Arabia (P. indicus) | Juvenil | G2-G4 | Músculo/HP | 5/5 | NA |
Resultados y discusión
Examen de histopatología
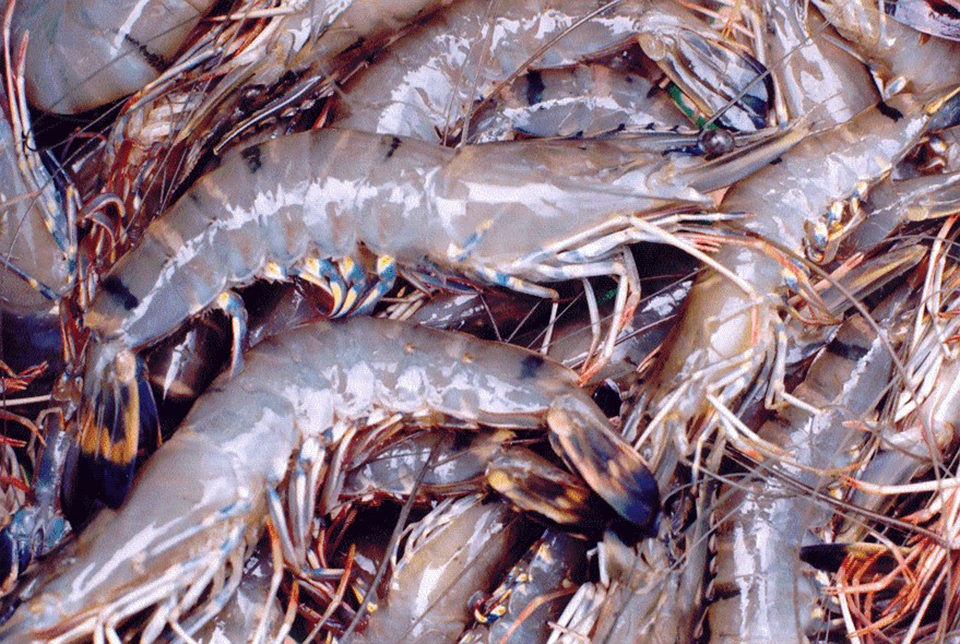
En camarones y otros crustáceos, Perezia spp. destruye los músculos y reemplaza gradualmente la musculatura por masas de etapas de desarrollo de parásitos y esporas. En las últimas etapas de la infección, los parásitos pueden invadir otros tejidos y órganos, como los cardiomiocitos, las células epiteliales y del tejido conectivo de las glándulas antenales, en el mismo camarón. En este estudio, varios tejidos del mismo camarón se vieron afectados por este microsporidio. El examen de histopatología reveló numerosas esporas de microsporidios en muestras recolectadas de Madagascar, Mozambique y Arabia Saudita. La infección afectó principalmente al hepatopáncreas y al músculo, en el nivel de gravedad correspondiente a grados que van desde G1 a G4.
Se observaron esporas maduras entre las fibras del músculo esquelético (Fig. 1A, B) y las etapas previas a las esporas y las esporas del epitelio infectado de los túbulos del hepatopáncreas (Fig. 1C, D). En las infecciones graves, también se observaron esporas dentro de las células epiteliales del filamento branquial (Fig. 1E, F), fibras musculares cardíacas (Fig. 1G) y células parenquimatosas del órgano linfoide (Fig. 1H). Las esporas que se extienden por todo el organismo en las etapas avanzadas de la infección podrían haberse derivado de la infección muscular: los músculos se deterioraron gradualmente y las esporas contaminaron los tejidos circundantes. Además, la mayoría de los casos (90 por ciento) de CSD fueron acompañados por infecciones de la enfermedad de ensuciamiento de las branquias causadas por Zoothamnium sp. o Epistylis sp., que indicó que los animales que sufren microsporidiosis probablemente eran débiles y susceptibles a infecciones secundarias o infestaciones.
Secuencia de SSU de rADN del nuevo microsporidio que causa CSD
Realizamos una PCR dirigida a las secuencias de SSU de rADN de los camarones que exhibían CSD, recolectados en Madagascar, y se obtuvo un fragmento de 1,2 kbp y se secuenciaron. La secuencia de nucleótidos de SSU de rADN se depositó en Genbank. Según los resultados de la prueba, la secuencia de nucleótidos tenía una identidad del 94 por ciento con la secuencia de SSU de rADN de Pleistophora sp. infectando a Penaeus setiferus, y 93 por ciento de identidad con la de un microesporido no identificado de Metapenaeus joineri. En 2002, Pleistophorasp. de P. setiferus fue re-identificado como Perezia nelsoni mediante exámenes morfológicos. En base a la información de secuencia, por lo tanto, ahora consideramos que el microsporidio recién identificado pertenece al género Perezia, y nos referiremos a él como Perezia sp. lo sucesivo. La CSD causada por Pereziasp. parece extenderse a varios países productores de camarones, incluidos Madagascar, Mozambique, Arabia Saudita (el presente estudio), Estados Unidos y Japón, pero no se ha estudiado lo suficiente.
En este estudio, los ADN genómicos extraídos de las muestras de Madagascar y Arabia Saudita se sometieron a PCR con cebadores específicos dirigidos a SSU de rADN. Las secuencias obtenidas fueron 100 por ciento idénticas para ambas muestras. Casualmente, el virus del síndrome de la mancha blanca (WSSV) detectado en estos mismos 3 países (Madagascar, Mozambique y Arabia Saudita) también mostró patrones genómicos idénticos.
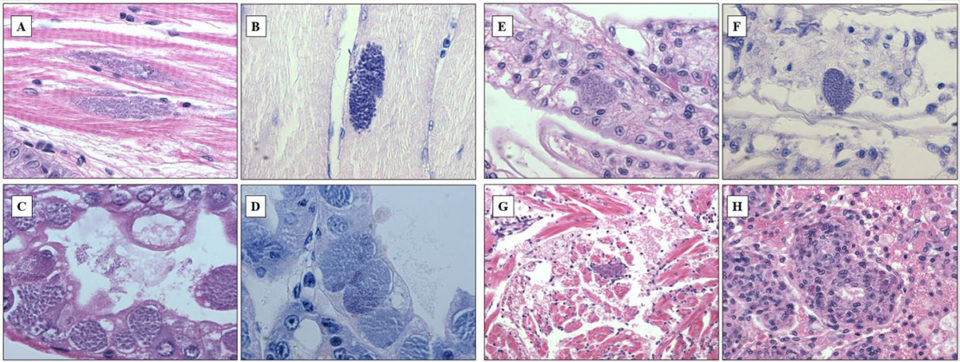
Perezia sp. – ISH específico
La sonda reaccionó fuertemente tanto al músculo esquelético como al hepatopáncreas (Fig. 2A-C), y también a otros órganos como las branquias, el corazón y los órganos linfoides (datos no mostrados), correspondientes a los resultados de histopatología. La sonda diseñada a partir de la secuencia de SSU de rADNr de Perezia sp. parecía ser específico para camarones con síntomas de CSD de Madagascar, Mozambique y Arabia Saudita.
Al principio, identificamos erróneamente la infección de Perezia sp. como infección por EHP mediante examen histopatológico normal. Sin embargo, esta sonda ISH no reaccionó a P. stylirostris infectado con E. hepatopenaei (Fig. 2D). No se observó reacción en ninguno de los tejidos preparados a partir de P. vannamei libre de patógenos. Tampoco P. vannamei y P. monodon, así como los poliquetos infectados con un microsporidio similar a Agmasoma no identificado, no reaccionaron a las sondas ISH (datos no incluidos aquí).
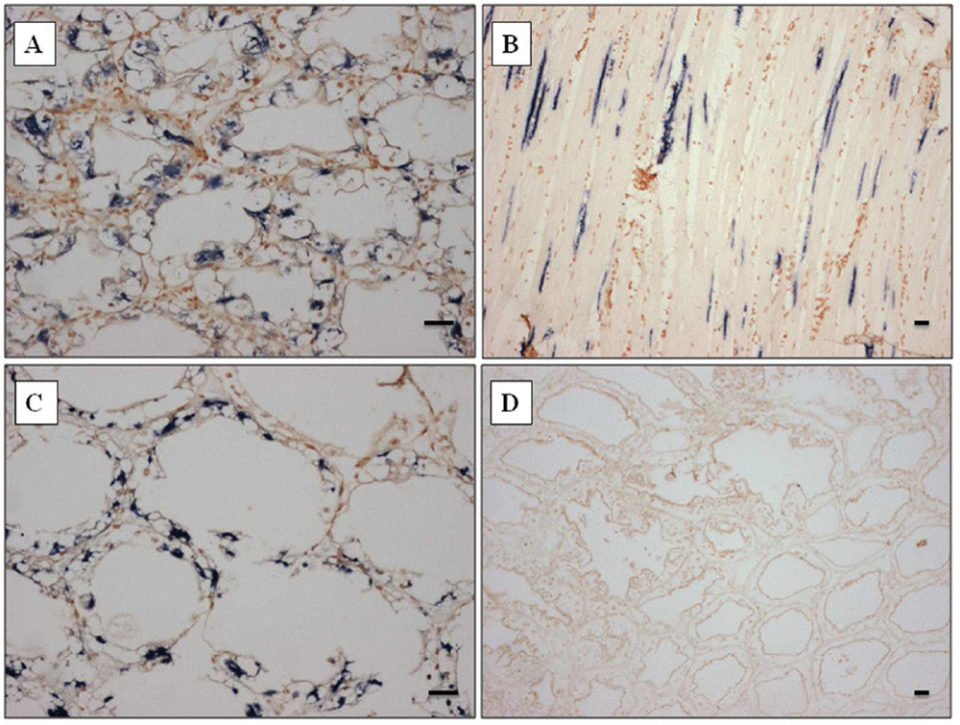
Perezia sp. – PCR específica
Para fines de diagnóstico, diseñamos un par de cebadores de PCR dirigidos al ADN de Perezia sp. y generamos un amplicón de 443 pb (término de biología molecular para designar una pieza de ADN o ARN que es la fuente y/o producto de los eventos de amplificación o replicación), que se muestra en la Fig. 3. Esta reacción de PCR es específica del microsporidio Perezia sp. que causa CSD, y por lo tanto puede ser útil para monitorear este parásito. Estos cebadores no reaccionaron al ADN microsporidiano de los camarones infectados con E. hepatopenaei (datos no mostrados). Además, no hubo reacción cruzada al ADN genómico de los camarones (P. vannamei, P. monodon, P. indicus, P. stylirostris y Macrobrachium rosenbergii), poliquetos, calamares y Artemia spp. (datos no mostrados).
No analizamos las muestras de Mozambique por PCR, pero la sonda reaccionó intensamente a ISH depositando los productos de reacción en las células objetivo en las muestras de Mozambique. En este estudio, describimos microsporidios que infectan los músculos y el hepatopáncreas que causan CSD en camarones de Madagascar, Mozambique y Arabia Saudita en la región del Mar Rojo-Océano Índico.
Perspectivas
Las infecciones microsporidianas se confirmaron mediante análisis histopatológico y los parásitos se identificaron como Perezia sp. Además, desarrollamos ensayos de ISH y PCR capaces de detectar este parásito. Estos métodos pueden ayudar a los productores de camarones en el diagnóstico y manejo de la CSD causada por el microsporidio Perezia sp.
Referencias disponibles de la primera autora.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (la Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $ 50 al año.
Authors
-

Jee Eun Han, DVM, Ph.D.
Laboratory of Aquatic Biomedicine, College of Veterinary Medicine
Kyungpook National University, Daegu 41566, Korea -
Seung Chan Lee
Laboratory of Aquatic Biomedicine, College of Veterinary Medicine
Kyungpook National University, Daegu 41566, Korea -
Seul Chan Park
Laboratory of Aquatic Biomedicine, College of Veterinary Medicine
Kyungpook National University, Daegu 41566, Korea -
Marc Le Groumellec, DVM, Ph.D.
AQUALMA, Aquaculture de la Mahajamba
Mahajanga 401, Madagascar
Tagged With
Related Posts

Health & Welfare
Detección de un parásito amebiano en camarón blanco del Pacífico cultivado
Este estudio describe una infección por parásitos amebianos en camarones blancos del Pacífico cultivados en un criadero de camarones anónimo. El camarón enfermo exhibió un apetito muy reducido, letargo, dificultad respiratoria, caparazones erosionados y branquias ennegrecidas.

Health & Welfare
Enfermedad emergente: el Virus Iridiscente de Hemocitos de Camarón (SHIV)
SHIV es un nuevo virus del camarón blanco del Pacífico en la familia Iridoviridae. Los autores también desarrollaron un ensayo ISH y un método de PCR anidado para su detección específica.

Health & Welfare
Herramienta diagnóstica no-invasiva desarrollada para la enfermedad EMS del camarón
La presencia de AHPND-Vibrio parahaemolyticus puede ser detectada tanto en muestras de ADN fecal como en caldo bacteriano enriquecido con muestras de caldo de enriquecimiento que muestran mayor sensibilidad.

Health & Welfare
Probióticos benefician al camarón blanco del Pacífico desafiado con AHPND
Un estudio fue llevado a cabo para medir los efectos de probióticos comerciales en camarón blanco del Pacífico en un modelo de desafío a AHPND estandarizado bajo condiciones controladas de laboratorio. Los resultados muestran que los tratamientos de probióticos por sí mismos tienen efectos beneficiosos, como una mayor supervivencia y signos histológicos de regeneración de hepatopáncreas.


