Este estudio es el primero en reportar una “fase persistente” de esta importante enfermedad

Desde 2009, la enfermedad de Necrosis Hepatopancreática Aguda (AHPND) se propagó progresivamente como una epidemia, devastando la producción de camarón en gran parte de las regiones de cultivo de camarón en Asia y, finalmente, en el hemisferio occidental, incluido un brote identificado en una granja en los Estados Unidos.
Las estimaciones anteriores del impacto económico acumulativo de AHPND han oscilado entre $ 8 mil millones (EE.UU.) para Asia y $ 4 mil millones para Estados Unidos. Sin embargo, en los últimos años, la producción de camarón ha mejorado en países previamente afectados por AHPND, ya que los productores han probado, mejorado y adaptado prácticas de cría que mitigan importantes factores de riesgo ambiental, y a medida que han evolucionado el conocimiento de las características moleculares, los métodos de detección y las opciones para el manejo de AHPND.
La lista de bacterias que pueden causar AHPND incluye: V. parahaemolyticus (VPAHPND), Vibrio campbellii, V. harveyi, V. owensii y V. punensis. La patología de AHPND tiene dos fases distintas. En la fase aguda, el hepatopáncreas infectado muestra desprendimiento de las células epiteliales de los túbulos de la membrana basal y degeneración del epitelio de los túbulos en ausencia de células bacterianas. En la etapa terminal, el hepatopáncreas muestra una infiltración hemocítica intratubular extensa y el desarrollo de una infección bacteriana secundaria masiva.
Las evidencias anecdóticas sugieren que en América Latina, la AHPND podría estar presente en varios países, incluido México y a través de América del Sur. Aunque la cepa Latinoamericana de VPAHPND también es altamente patógena, a menudo la VPAHPND no causa mortalidad aguda y, de hecho, en la región, la producción de camarón ha aumentado de manera constante durante los últimos 10 años.
Este artículo, resumido de la publicación original [L.F. Aranguren Caro et al. 2020. Acute hepatopancreatic necrosis disease (VPAHPND), a chronic disease in shrimp Penaeus vannamei population raised in Latin America. Journal of Invertebrate Pathology, Vol. 174, July 2020, 107424] reporta sobre ensayos de desafio de VPAHPND realizados con camarón blanco del Pacífico (Penaeus vannamei) en el Laboratorio de Patología Acuícola (APL) siguiendo la metodología estándar de bioensayo, así como evaluaciones realizadas para documentar la histopatología y el recuento de placas heterotróficas del hepatopáncreas (HPC)]. Nuestros resultados ayudan a explicar la relativa falta de mortalidad aguda observada en las granjas camaroneras en América Latina.
Configuración del estudio
Camarones e inóculo
Las líneas Latinoamericanas (All Pathogens Exposed, APE) de P. vannamei fueron importadas a los Estados Unidos hace varios años por una empresa comercial. En 2017-2018, tres líneas de descendientes de quinta generación derivadas de la población fundadora se enviaron al APL para bioensayos de desafío con VPAHPND. P. vannamei libre de patógenos específicos (SPF) (conocido por ser altamente susceptible al AHPND) fue suministrado por una entidad comercial en los Estados Unidos y sirvió como línea de control positivo en los dos ensayos que realizamos.
La cepa de referencia, Vibrio parahaemolyticus, 13-028 / A3 (denominada VPAHPND), una cepa bacteriana causante de AHPND, se utilizó para ambos ensayos de desafio. Se cultivó VPAHPND en caldo de soya tríptica con 2 por ciento de NaCl (TSB+) a 28 a 29 grados-C con agitación (120 rpm) durante 18 horas o hasta una absorbancia de densidad óptica bacteriana de 3.0 a OD600 nm (~ 109 UFC (unidades formadoras de colonias) ) por ml) se alcanzó.
Pruebas de desafío
En este estudio se llevaron a cabo dos ensayos de desafio con VPAHPND. Para los tanques de exposición (ambos ensayos), se añadió VPAHPND en TSB directamente al agua de cada tanque de desafío para lograr una densidad estimada de 1 × 105UFC por ml de agua del tanque de bioensayo. No se realizó intercambio de agua después de la inoculación bacteriana. La mortalidad se registró diariamente para cada tanque desde el inicio de cada experimento.
Ensayo I
El propósito del Ensayo I fue documentar la supervivencia para comparar tres líneas de camarón, sus controles negativos y el control positivo SPF. Tres repeticiones de tanques para cada una de las líneas de prueba y dos tanques replicados con animales SPF se sometieron a desafío de inmersión, con cada tanque con 21 ± 3 camarones. Las poblaciones de SPF presentes en los tanques de retención se consideraron como la prueba de tratamiento de control negativo para la línea SPF en el Ensayo I. Todos los camarones supervivientes se fijaron al final del desafío para el examen histológico [anatomía microscópica de tejidos biológicos]. La duración del ensayo fue de 11 días.
Ensayo II
El Ensayo II se llevó a cabo para medir el recuento en placa heterotrófica del hepatopáncreas (HP) [HPC; un procedimiento para estimar el número de bacterias heterotróficas vivas en el hepatopáncreas]; histología a las 24 horas después de la infección (h.p.i); así como los conteos de supervivencia final y la histología al final del ensayo seis días después de la infección (dpi) Para compensar un posible efecto de tanque, siete camarones de cada línea y un número similar de población de SPF se sembraron en un tanque de 1,000 litros, mientras que Los camarones marcados restantes de cada grupo se colocaron en el tanque de control negativo. Para identificar los camarones individuales en el grupo, a cada animal se le inyectó una etiqueta de elastómero de color (color diferente para cada línea). El día 0, el tanque de tratamiento fue desafiado con VPAHPND siguiendo el mismo protocolo descrito para el Ensayo I.
Para obtener información detallada sobre el diseño del estudio y el protocolo experimental; PCR dúplex para la detección de genes similares a pirA y pirB; histopatología; y análisis estadísticos, consulte la publicación original.
Resultados
Supervivencia acumulada para los Ensayos I y II
El análisis de los valores de supervivencia mediante el método de Kaplan-Meier reveló una diferencia significativa (P <0,001) entre la línea APE1 (72,1 ± 17,4 por ciento) y las otras tres líneas expuestas a VPAHPND (Fig. 1). Las líneas APE2 y APE3 tuvieron supervivencias finales similares de 16,1 ± 5,3 por ciento y 17,0 ± 10,1 por ciento, respectivamente, y la línea SPF tuvo la supervivencia más baja (12,5 ± 10,6 por ciento). La supervivencia no fue significativamente diferente (P> 0.05) entre las líneas APE2, APE3 y SPF. Para cada una de las cuatro líneas probadas, la supervivencia media del control negativo (95,2 ± 4,6 por ciento) fue significativamente mayor (P <0,001) que la supervivencia media del tratamiento correspondiente.

PCR
Se recolectaron y combinaron 11 muestras de hepatopáncreas de camarones muertos en el ensayo I de VPAHPND por línea / tanque y se analizaron mediante una prueba de PCR dúplex [una prueba de reacción en cadena de la polimerasa que detecta y diferencia simultáneamente dos genes diferentes, pirA y pirB, que codifican la toxina binaria] para detectar pirA y pirB. Todas las muestras agrupadas fueron positivas tanto para pirA como para pirB y se observaron claramente las bandas que amplifican la región de 284 pb y 392 pb. Las muestras de las líneas no expuestas (controles negativos) se agruparon por tanques y se analizaron mediante PCR dúplex, con resultados negativos en todos los casos.
Histopatología
La histopatología de la población SPF en el Ensayo II se presenta en las Figs. 2 y 3. El camarón fijado por Davidson [una solución fijadora para conservar muestras de tejido] del camarón de control negativo sano en la línea SPF mostró una estructura normal de túbulos y células epiteliales en el hepatopáncreas, incluidos altos niveles de gotitas de lípidos (R- células), vacuolas secretoras (células B) y ausencia de AHPND (Fig. 2A). Por el contrario, los camarones SPF fijados en el primer y segundo día después de la infección (dpi) mostraron lesiones típicas de VPAHPND en la fase aguda, incluida una necrosis multifocal [células muertas en varios lugares] y desprendimiento masivo de células epiteliales de túbulo del HP en la región medial del hepatopáncreas y progresando hacia la región distal. Se observaron niveles muy bajos de células B y células R (G0-G1) y fue común la infiltración hemocítica alrededor de los túbulos necróticos. En este punto, no se observó colonización bacteriana (Fig. 2B).

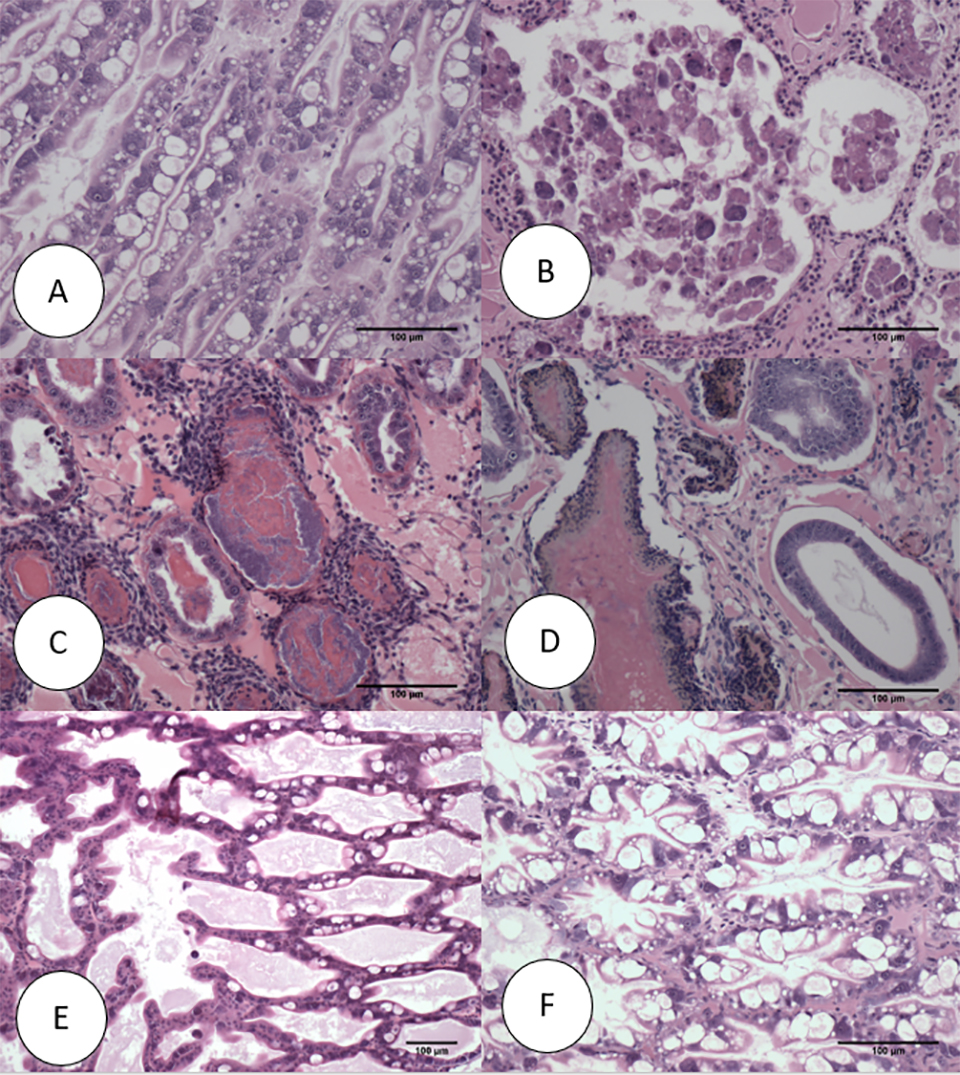
Algunos de los otros camarones SPF analizados mostraron la fase terminal VPAHPND típica caracterizada por necrosis y desprendimiento de células epiteliales del túbulo HP a (Fig. 2C) presencia bacteriana masiva y respuesta inflamatoria del huésped entre y dentro de los túbulos HP. Curiosamente, algunos supervivientes a 7 dpi mostraron solo unos pocos túbulos con necrosis epitelial acompañada de bacterias e inflamación, que se asemeja a una Necrosis Hepatopáncreática Séptica (NPSH) (Fig. 2D), que no se había descrito previamente como un tipo de lesión en el caso. definición de AHPND (Tabla 1).
Aranguren, AHPND en camarón en Latinoamérica, Tabla 1
| Tanque No. | Línea de camarón | No. camarones | Tratamiento | Dosis de desafio de inmersión de AHPND-VP (UFC/ml) |
|---|
Tanque No. | Línea de camarón | No. camarones | Tratamiento | Dosis de desafio de inmersión de AHPND-VP (UFC/ml) |
|---|---|---|---|---|
| A4 | APE2 | 22 | AHPND Control negativo | No expuesto |
| A5 | APE3 | 19 | AHPND Control negativo | No expuesto |
| A6 | APE1 | 25 | AHPND Control negativo | No expuesto |
| L1 | SPF | 20 | AHPND Control positivo | 1 × 10^5 |
| L2 | SPF | 20 | AHPND Control positivo | 1 × 10^5 |
| D1 | APE2 | 18 | AHPND | 1 × 10^5 |
| D2 | APE2 | 19 | AHPND | 1 × 10^5 |
| D3 | APE2 | 19 | AHPND | 1 × 10^5 |
| D4 | APE3 | 19 | AHPND | 1 × 10^5 |
| D5 | APE3 | 21 | AHPND | 1 × 10^5 |
| D6 | APE3 | 17 | AHPND | 1 × 10^5 |
| 5A | APE1 | 25 | AHPND | 1 × 10^5 |
| 5B | APE1 | 28 | AHPND | 1 × 10^5 |
| 5C | APE1 | 25 | AHPND | 1 × 10^5 |
Por otro lado, la histopatología de camarones que representan las líneas latinoamericanas (APE1, APE2 y APE3) se presenta en la Fig. 3. La Fig. 3A muestra la histología del HP de un camarón sano del tanque de control negativo APE. La histología fue similar a la histología de HP normal en los animales de la línea SPF. Figs. 3B y 3C, respectivamente, son ejemplos de histología de la fase aguda y terminal típica de AHPND y la Fig. 3D es un ejemplo de la aparición de la histología de AHPND de fase crónica para un camarón superviviente después de 6 d.p.i. Se observaron lesiones histopatológicas crónicas similares en camarones en la línea SPF. La respuesta granulomatosa en los túbulos HP sería un indicador de una respuesta inflamatoria en una etapa más avanzada de madurez en la fase crónica en camarones afectados por AHPND. A diferencia del conjunto de figuras anterior, la figura 3E presenta un caso sospechoso de AHPND (trazo G) con necrosis focal y desprendimiento de células epiteliales de los túbulos en la porción medial de HP. Dos supervivientes de APE1 no tenían lesiones histopatológicas indicativas de AHPND, lo que sugiere una posible tolerancia / resistencia a la infección por AHPND (Fig. 3F).
Bacteriología
La Fig. 4 resume el HPC para el HP del control y el camarón desafiado con VPAHPND a 24 h.p.i. Para el grupo de control negativo, el recuento medio más alto se registró para APE1 (2,22 × 107 UFC por gramo de HP). Por el contrario, el recuento de control medio más bajo fue para la línea SPF (1,05 × 104 UFC por gramo de HP). El 24 h.p.i. Las muestras de tanque de desafío VPAHPND mostraron que la HPC aumentó significativamente (P <0,05) entre los camarones de control y de tratamiento para las líneas APE2, APE3 y SPF, con el recuento medio diferencial más grande: 3.70 × 107 UFC por gramo de HP para la línea SPF, ~ 103 veces mayor que el recuento medio de control negativo para esta línea (1,05 × 104 UFC por gramo de HP). La línea APE1 tuvo pocos cambios en la media de UFC por gramo de HP entre el control negativo (2,20 × 107 UFC por gramo de HP) y las muestras de cohorte desafiadas con VPAHPND (2,13 × 107 UFC por gramo de HP) en el estudio.

Discusión
En este estudio, cuatro líneas de camarón P. vannamei, incluida una línea SPF y tres líneas de camarón Latinoamericanas, fueron desafiadas por inmersión con una cepa virulenta de VPAHPND usando una densidad de células bacterianas de ~ 1 × 105 UFC por ml. Una de las líneas Latinoamericanas (línea APE1) mostró una supervivencia significativamente mejorada en comparación con las líneas APE2, APE3 y SPF al desafío VPAHPND bajo condiciones experimentales de laboratorio examinadas.
Se registraron lesiones de fase aguda y terminal de AHPND en camarones moribundos en los dos ensayos. En el Ensayo I, el camarón superviviente (6 d.p.i) también mostró un cambio histológico y Necrosis Hepatopancreática Séptica (SHPN) (Figuras 2D, 3C y 3D). Es interesante notar que la SHPN no se incluyó en la descripción patológica de AHPND (Lightner & Flegel 2012, OIE 2018) probablemente porque durante los primeros años de la infección en el sudeste Asiático, la mortalidad fue cercana al 100 por ciento en la mayoría de los casos. casos.
Hasta donde sabemos, este es el primer registro de SHPN en camarones infectados con VPAHPND. Otros cambios crónicos en el hepatopáncreas observados fueron granulomas, melanización focal o multifocal de los túbulos HP, lípidos citoplasmáticos bajos y atrofia de las células epiteliales de los túbulos. Un superviviente del grupo APE tenía necrosis epitelial túbulo leve (Fig. 3E) y en otra muestra no se observaron lesiones de AHPND en absoluto (Fig 3F). Estas características histológicas podrían indicar tolerancia / resistencia en camarones de la línea APE 1.
En el Ensayo II, la HPC en el hepatopáncreas aumentó a las 24 h.p.i. en los tratamientos VPAHPND en comparación con el tanque de control negativo para las líneas APE2, APE3 y SPF. Los recuentos de control de CFU por gramo de HP en las líneas APE2, APE3 y SPF oscilaron entre ~ 104 y ~ 106; mientras que para la línea APE1, las UFC por gramo de HP fueron significativamente más altas (media = 2,20 × 107 gramos de HP). El control más alto para desafiar el diferencial fue 1:3,01 × 103 para la línea SPF; mientras que para la línea APE1 de alta supervivencia, la diferencia media fue de 1.04:1, esencialmente sin cambios entre el control y el camarón desafiado con VPAHPND.
Después del desafío VPAHPND, la media de UFC por gramo de HP aumentó para las líneas 2, 3 y 4. La media de HPC fue de 1,7 × 107 UFC por gramo de HP (rango: 9,52 × 104 a 1,05 × 108 UFC por gramo de HP). Aunque la carga bacteriana fue bastante variable entre los diferentes animales, la media de UFC fue consistente con estudios de prueba de desafio previos que hemos llevado a cabo en APL. En nuestros datos, el recuento bacteriano del hepatopáncreas que estaba compuesto por el VPAHPND, así como la flora bacteriana natural, probablemente aumentó en respuesta a la mayor disponibilidad de nutrientes (restos celulares necróticos y membrana basal de túbulos expuestos) en los HP afectados.
En este estudio, la supervivencia mejorada se asoció con una HPC de hepatopáncreas muy alta antes de la exposición a VPAHPND en la línea APE1. Quizás una alta biomasa inicial de bacterias en el estómago / hepatopáncreas tuvo una influencia negativa en la colonización y / o replicación de V. parahaemolyticus, ya sea a través del antagonismo directo de bacterias a bacterias y / o la alta carga de bacterias se asoció con una mayor actividad del sistema inmunológico innato de los camarones, dando así a los animales APE1 individuales una mayor tolerancia del huésped a AHPND. En cualquier caso, valdría la pena explorar más a fondo la (s) razón (es) detrás de la mayor supervivencia registrada para APE1.
A pesar de la fuerte evidencia de la presencia de AHPND en América Latina, la producción de camarón cultivado en esta región ha crecido continuamente durante los últimos 10 años (GOAL 2019, FAO 2018). Las mortalidades crónicas causadas por AHPND a nivel de granja en estanques de engorde fueron similares a las mortalidades crónicas reportadas en nuestro estudio a través de una prueba de desafío VPAHPND de las líneas de camarón utilizadas en América Latina. Para explicar esta resistencia / tolerancia al AHPND, es importante observar la historia de la industria del camarón en América Latina. Desde los primeros días, la gran mayoría de las granjas en América Latina han utilizado un enfoque de “vivir con los patógenos,” conocido como Expuesto a Todos los Patógenos (APE).
La industria del camarón en los países Latinoamericanos ha estado expuesta a varios patógenos durante los últimos 30 años, incluidos patógenos virales como el Virus del Síndrome de Taura (TSV) de 1992 a 1995 y el Virus del Síndrome de la Mancha Blanca (WSSV) desde 1999. Sin otras opciones, algunos de los principales productores iniciaron un programa para seleccionar a los supervivientes, inicialmente de estanques infectados con TSV y más tarde de estanques infectados con WSSV.
A mediano plazo, la industria del camarón comenzó a ver cierta recuperación en sus estanques previamente afectados por estos patógenos virales. De 2010 a 2019, la industria del camarón en Ecuador, con mucho el mayor productor de camarón de las Américas, disfrutó de una mayor supervivencia y producción en estanques a pesar de la presencia de estos patógenos en los estanques de cultivo.
Durante el proceso de selección de TSV y WSSV por parte de los productores de camarones, algunas otras enfermedades, incluidas las bacterianas, han estado presentes a nivel de granja – incluido el SHPN y el síndrome de la gaviota – y algunas a nivel de criadero (incluido el V. harveyi bioluminiscente y el síndrome de Bolitas), que podría sugerir que estas poblaciones de APE han estado expuestas a varios patógenos bacterianos y han adquirido cierta tolerancia a múltiples patógenos simultáneamente. Además, los camarones seleccionados en Colombia por su resistencia al TSV adquirieron indirectamente resistencia a la Hepatopancreatitis Necrotizante (NHP), una enfermedad endémica presente en los estanques de reproductores en ese momento.

Creemos que podrían haber ocurrido desarrollos similares con estas poblaciones Latinoamericanas que encontraron infecciones por Vibrio durante las condiciones de cultivo de la granja. En las granjas camaroneras de América Latina, AHPND no conduce a la mortalidad aguda que ocurre en las granjas del sudeste asiático. Nuestro estudio es el primer informe de una nueva fase de infección de AHPND, una fase crónica basada en ensayos experimentales de desafío AHPND que realizamos utilizando líneas de camarón de América Latina. Nuestros resultados explican en parte por qué la industria del camarón en varios países de América Latina ha continuado expandiéndose independientemente de la presencia de AHPND. Además, nuestros resultados muestran que la biología y patología de los camarones resistentes / tolerantes a AHPND parecen ser bastante singulares en esta población de camarones de América Latina.
Perspectivas
En resumen, hemos descrito los resultados del desafío de bioensayo que identificaron una de las tres líneas Latinoamericanas que mostraron una supervivencia mejorada (~ 70 por ciento) al desafío de AHPND en comparación con las otras dos líneas de control positivo APE y SPF.
La diferencia en la supervivencia podría atribuirse a bacterias elevadas registradas en el HP de animales APE1 individuales y / o un atributo aún desconocido de tolerancia al AHPND en esta línea en comparación con las otras tres líneas evaluadas en los dos ensayos.
Se planean estudios comparativos adicionales para aprender más sobre bacteriología cualitativa y cuantitativa en muestras de hepatopáncreas recolectadas en el Ensayo II.
Referencias disponibles del autor correspondiente.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (La Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $50 al año.
Authors
-

Luis Fernando Aranguren Caro, Ph.D.
Corresponding author
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Hung N. Mai, Ph.D.
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Brenda Noble, B.Sc.
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Arun K. Dhar, Ph.D.
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA
Tagged With
Related Posts

Health & Welfare
EHP es un factor de riesgo para otras enfermedades del camarón
Desafíos de laboratorio y un estudio caso-control se utilizaron para determinar los efectos de la infección por EHP en dos enfermedades de Vibrio: necrosis hepatopancreática aguda (AHPND) y necrosis hepatopancreática séptica (SHPN).

Health & Welfare
Estudio de co-infección de WSSV y Vibrio parahaemolyticus
En este estudio, se estudió la co-infección del virus del síndrome de la mancha blanca y AHPND-Vibrio parahaemolyticus en camarones vannamei juveniles en condiciones de laboratorio.

Health & Welfare
Cuatro cepas de AHPND identificadas en granjas de camarón de América Latina
Se conocen dos genes de virulencia que codifican una toxina binaria de Photorhabdus relacionada con insectos que causa la enfermedad de necrosis hepatopancreática aguda en camarones. Las patogenicidades de estas cepas de V. campbellii fueron evaluadas mediante infección de laboratorio y posterior examen histológico en camarones P. vannamei.

Health & Welfare
Posibles aplicaciones de bacteriófagos para el control de AHPND
Un estudio demuestra que los fagos aislados probados son efectivos para controlar la infección por AHPND en camarones peneidos cultivados e inhibir el crecimiento bacteriano.

