Los resultados muestran un factor de riesgo para AHPND en camarones blancos del Pacífico

La enfermedad de necrosis hepatopancreática aguda (AHPND), causada por cepas específicas de la bacteria Vibrio parahaemolyticus (VpAHPND), se ha reportado en camarones cultivados en el sudeste asiático y América desde 2009. Los signos clínicos de la enfermedad incluyen hepatopáncreas (HP) atrofiado, un tracto gastrointestinal vacío, una apariencia lechosa del estómago y letargo. Esta enfermedad bacteriana ha causado hasta un 100 por ciento de mortalidad en las poblaciones de camarones blancos del Pacífico (Penaeus vannamei) y camarón tigre negro (P. monodon), y las pérdidas económicas colectivas debido a AHPND y otras enfermedades del camarón se estiman en $ 23.6 mil millones a nivel mundial, con una pérdida adicional de $ 7 mil millones en ventas de alimentos.
En algunos casos, se ha informado de VpAHPND en co-infección con el microsporidio formador de esporas Enterocytozoon hepatopenaei (EHP). Aunque la EHP no parece causar mortalidad, los animales infectados con EHP serían más vulnerables a la AHPND, lo que puede causar una mortalidad sustancial en los estanques de camarones. Y los camarones infectados con EHP tienen una mayor susceptibilidad a VpAHPND, lo que sugiere que los camarones debilitados por EHP sucumbirían a patógenos secundarios, como VpAHPND.
Durante varios años, el virus del síndrome de la mancha blanca (WSSV) se ha extendido por todo el mundo en gran parte de Asia, América, Europa, África, Oriente Medio y Australia. En algunos casos, se ha detectado WSSV en animales sanos sin síntomas clínicos o mortalidad, lo que indica que la infección por WSSV no necesariamente resulta en una alta mortalidad, y la infección secundaria por patógenos oportunistas, como Vibrio spp., aceleraría el inicio de la enfermedad .
En 2017, se reportaron tasas de mortalidad de P. vannamei de hasta el 60 por ciento en Filipinas. Los camarones exhibieron signos clínicos de AHPND, pero la PCR confirmó que eran positivos tanto para VpAHPND como para WSSV. A partir de este caso, planteamos la hipótesis de que la infección por WSSV sin síntomas clínicos permitiría que VpAHPND causara una mortalidad más rápida y mayor en los camarones cultivados en estanques que aquellos infectados solo con VpAHPND.
Este artículo, adaptado y resumido del original, informa sobre un estudio diseñado para apoyar esta hipótesis simulando la co-infección con WSSV y VpAHPND en camarones P. vannamei juveniles en condiciones de laboratorio. Como resultado, demostramos que los camarones expuestos inicialmente a WSSV fueron fácilmente infectados por VpAHPND, pero apenas se recuperaron de la enfermedad según el examen de histopatología. Además, utilizando el ensayo qPCR y la inmunohistoquímica [IHC; la aplicación más común de inmunotinción, que implica el proceso de identificación selectiva de antígenos (proteínas) en las células de una sección de tejido usando la unión de anticuerpos específicamente a antígenos en el examen de tejidos biológicos, determinamos que la infección por WSSV podría ser acelerada por la infección secundaria por VpAHPND .
Este trabajo fue apoyado por la subvención de la Fundación Nacional de Investigación de Corea (NRF) financiada por el gobierno de Corea (MSIT) (número de subvención NRF-2018R1C1B5086350).
Configuración del estudio
Postlarvas de P. vannamei se obtuvieron de una granja de camarones local (Provincia de Jeju, Corea del Sur) y se transportaron al Instituto de Ciencias Marinas de la Universidad Nacional de Jeju en Corea del Sur. Los camarones se criaron hasta un peso promedio de 0.5 ± 0.05 gramos en tanques de mantenimiento de 96 litros con agua de mar artificial aireada a una salinidad de 25 a 28 grados-C y 30 ppt. Para el experimento de co-infección, se seleccionaron al azar camarones juveniles (promedio 0.5 gramos, N = 80) de los tanques de mantenimiento y se distribuyeron en tanques experimentales. Antes del experimento de co-infección, se seleccionaron al azar camarones representativos y se confirmó por PCR que eran negativos tanto para WSSV como para VpAHPND.
Para las poblaciones de WSSV, se recolectaron P. vannamei moribundos, con manchas blancas en sus cutículas, de una granja anónima de camarones en la Provincia de Chungcheong, ubicada en la costa occidental de Corea. Para las bacterias VpAHPND, la cepa 13-028/A3 se aisló previamente del estómago de P. vannamei moribundos de una granja en Vietnam y que tenían hepatopáncreas (HP) blanquecinos.
Para obtener información detallada sobre los diseños experimentales para la co-infección por WSSV y VpAHPND; ensayos de qPCR; examen IHC de los tejidos branquiales; examen histopatológico de los tejidos de HP; y análisis estadísticos, consulte la publicación original.
Resultados y discusión
Estudiamos la co-infección con WSSV y VpAHPND en camarones P. vannamei juveniles en condiciones de laboratorio, y las tasas de mortalidad se compararon con grupos de infección únicos.
Nuestros resultados mostraron que la co-infección aceleró la mortalidad de camarones en comparación con la infección única (Fig. 1). Observamos un 0 por ciento de mortalidad en el Grupo 1 (solo WSSV), y la mortalidad acumulada fue del 50 por ciento en el día 4 después de la infección (p.i.) en el Grupo 2 (solo VpAHPND). Sin embargo, la tasa de mortalidad aumentó significativamente en el Grupo 3 (WSSV + VpAHPND) en comparación con los otros grupos (p <.05). En el Grupo 3, los camarones comenzaron a mostrar mortalidad en el día 2 p.i., y la mortalidad acumulada alcanzó el 75 por ciento en el día 3 p.i. Durante el período experimental de 10 días, no se observó mortalidad en el control negativo (Grupo 4, no cuestionado).
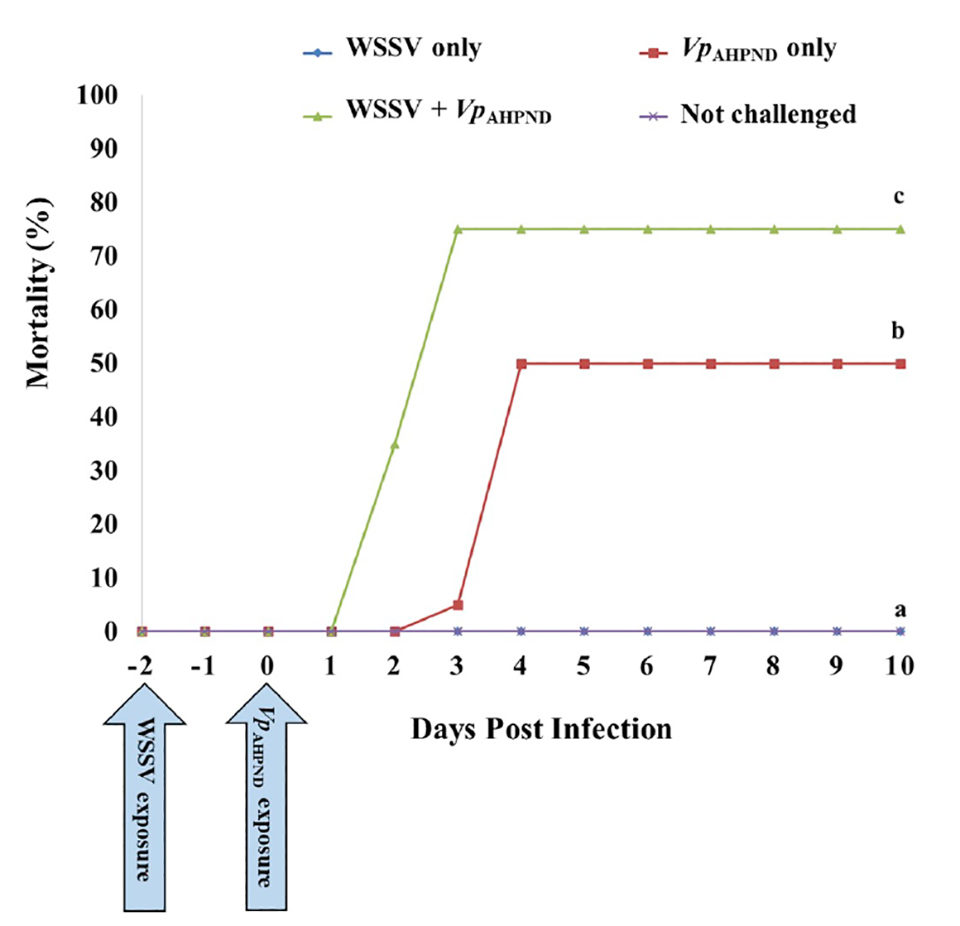
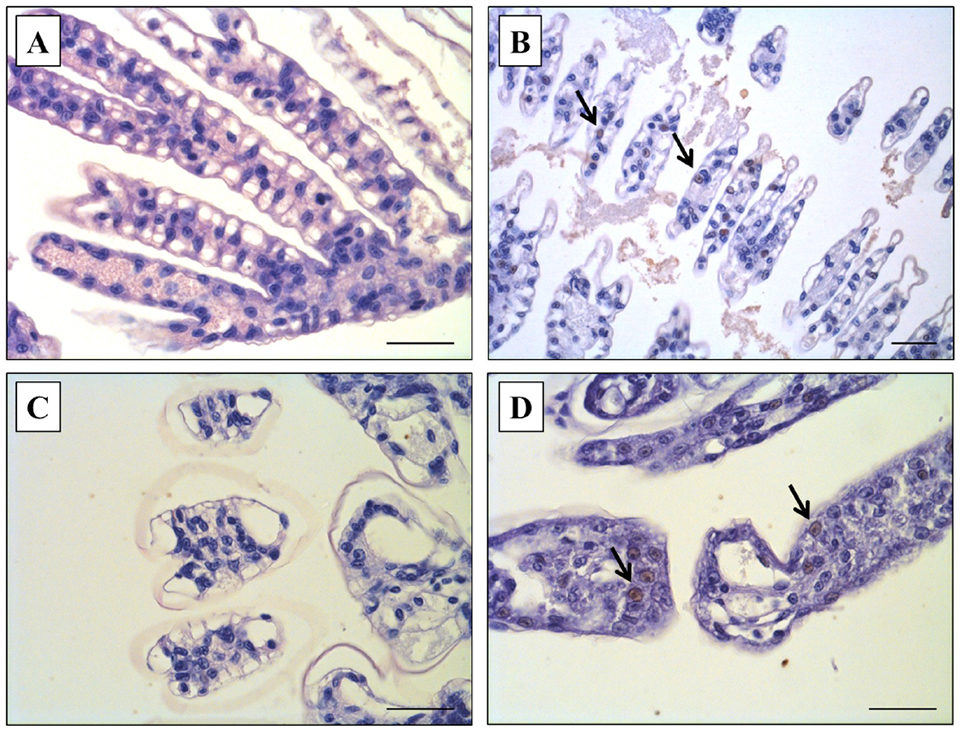
Nuestros resultados también mostraron que la co-infección aumentó el nivel de infección por WSSV, que se confirmó mediante qPCR e IHC, y los niveles de infección por WSSV fueron notablemente diferentes entre el Grupo 1 (solo WSSV) y el Grupo 3 (WSSV + VpAHPND) en la terminación día (día 10). Según el análisis de qPCR, se detectó WSSV en camarones en el Grupo 3 (WSSV + VpAHPND) pero WSSV fue negativo en camarones expuestos únicamente a WSSV (Grupo 1). Además, mediante el examen IHC, la coloración marrón contra el citoplasma rosado y los núcleos morados, se observaron reacciones indicativas positivas para WSSV en los camarones del Grupo 3 (WSSV + VpAHPND) (Fig. 2D) similar a la muestra positiva para WSSV preparada previamente en el estudio preliminar (Fig. 2B). Sin embargo, estas reacciones positivas al WSSV no se observaron en los camarones expuestos al WSSV solo (Grupo 1; Fig. 2A) y el control negativo (Grupo 4, no desafiado; Fig. 2C).
La co-infección disminuyó la recuperación de la infección por VpAHPND. Todos los camarones experimentales mostraron síntomas clínicos típicos de AHPND, incluyendo HP pálido e intestino vacío, dentro de los tres o cuatro días posteriores a la infección en el Grupo 2 (solo VpAHPND) y el Grupo 3 (WSSV + VpAHPND), y la infección por VpAHPND fue confirmada por qPCR y el examen histopatológico. Del análisis qPCR, se detectó VpAHPND en camarones muertos recolectados tanto del Grupo 2 (solo VpAHPND) como del Grupo 3 (WSSV + VpAHPND) en los días 3 y 4.
Mediante un examen histopatológico, los camarones representativos tanto del Grupo 2 (solo VpAHPND) como del Grupo 3 (WSSV + VpAHPND) mostraron una fase terminal típica, caracterizada por infección bacteriana masiva y desprendimiento de células epiteliales del túbulo hepatopancreático a nivel de G3-4 (grado 4 es el más severo) en el día 3.
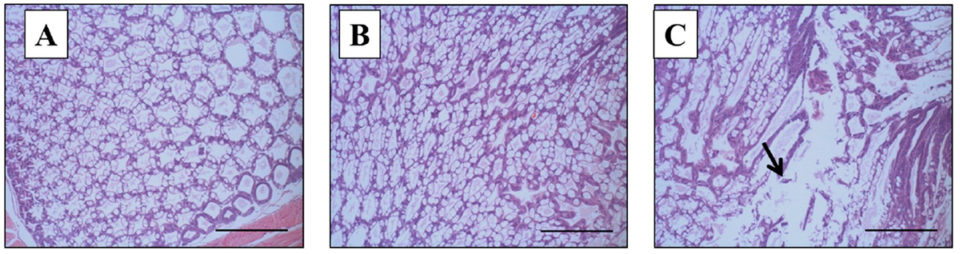
Sin embargo, en el día de finalización (día 10), se observó una diferencia notable en la histopatología de HP del camarón sobreviviente entre el grupo 2 (solo VpAHPND) y el Grupo 3 (WSSV + VpAHPND). Los signos de histopatología de los sobrevivientes del grupo 2 (solo VpAHPND) tenían un HP de apariencia y funciones normales de las células B y R (Fig. 3B), lo mismo que el control negativo (Grupo 4, Fig. 3A). Por el contrario, los sobrevivientes del Grupo 3 (WSSV + VpAHPND) mostraron signos típicos de histopatología AHPND en el HP, con infección bacteriana masiva y desprendimiento de células epiteliales del túbulo hepatopancreático de gravedad G4 (Fig. 3C).
Las infecciones con múltiples patógenos (co-infección) son comunes en cultivos prácticos de camarones. Se han reportado varios casos de vibriosis de camarones con infección por WSSV en varias especies de peneidos en diferentes países. No ha habido un análisis detallado previo sobre el papel de estos patógenos en camarones co-infectados con WSSV y Vibrio. En las granjas de camarones, la infección por WSSV sin síntomas o mortalidad probablemente causa el debilitamiento de los camarones y podría desencadenar la infección por VpAHPND.
También observamos disminuciones en las enzimas anti-oxidantes y anti-peroxidativas en camarones infectados con VpAHPND, similar al WSSV en nuestro estudio en curso, y sospechamos que la infección por VpAHPND también puede haber comprometido a los animales, aumentando su susceptibilidad a otros patógenos en los estanques.
Las rutas intramusculares (IM) se han utilizado ampliamente para la infección experimental de camarones con WSSV. Sin embargo, la inyección IM no se ha considerado como una ruta de infección de VpAHPND. Además, la alimentación per os puede producir infección por WSSV y VpAHPND, pero este no es un método práctico para los experimentos de doble infección porque se suponía que los camarones experimentales se infectarían dos veces en intervalos cortos. Por lo tanto, para el bioensayo actual, seleccionamos el método de inmersión (a base de agua) para co-infectar los camarones con WSSV y VpAHPND. Los efectos sinérgicos influenciados por las mismas rutas de infección ya se han confirmado entre WSSV y Vibrio spp.
Perspectivas
Hasta donde sabemos, nuestro estudio es el primero en examinar la co-infección de WSSV y VpAHPND en condiciones de laboratorio. En los estanques, los camarones infectados con WSSV (u otros patógenos) no siempre mostraron signos clínicos o mortalidad. En esos casos, incluso los camarones positivos al WSSV sin ningún síntoma clínico pueden causar una mortalidad más alta y rápida que sus contrapartes libres de enfermedad, y los camarones difícilmente se recuperarían de la enfermedad después de una infección secundaria, como VpAHPND.
Además, la infección secundaria provocaría la infección por WSSV o la replicación del virus, como se confirma en el presente estudio. Por lo tanto, los productores de camarones deben prestar atención al manejo de múltiples infecciones (WSSV u otros patógenos) en sus estanques para evitar mayores pérdidas en la producción de camarones.
Referencias disponibles en la publicación original.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (la Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $ 50 al año.
Authors
-

Jee Eun Han, DVM, Ph.D.
Laboratory of Aquatic Biomedicine
College of Veterinary Medicine
Kyungpook National University
Daegu 41566, Korea -
Ji-Eun Kim, MS
Institute of Integrated Technology
CJ CheilJedang, CJ Blossom Park
Suwon 16495, Republic of Korea -
Hayun Jo, MS
Institute of Integrated Technology
CJ CheilJedang, CJ Blossom Park
Suwon 16495, Republic of Korea -
Jong-Su Eun, Ph.D.
Institute of Integrated Technology
CJ CheilJedang, CJ Blossom Park
Suwon 16495, Republic of Korea -
Chorong Lee, Ph.D.
Department of Marine Life Sciences
Jeju National University
Jeju 63243, Republic of Korea -
Ji Hyung Kim, Ph.D.
Infectious Disease Research Center
Korea Research Institute of Bioscience and Biotechnology
Daejeon 34141, Republic of Korea -
Kyeong-Jun Lee, Ph.D.
Department of Marine Life Sciences
Jeju National University
Jeju 63243, Republic of Korea -
Jae-Won Kim, Ph.D.
Institute of Integrated Technology
CJ CheilJedang, CJ Blossom Park
Suwon 16495, Republic of Korea
Tagged With
Related Posts

Health & Welfare
EHP es un factor de riesgo para otras enfermedades del camarón
Desafíos de laboratorio y un estudio caso-control se utilizaron para determinar los efectos de la infección por EHP en dos enfermedades de Vibrio: necrosis hepatopancreática aguda (AHPND) y necrosis hepatopancreática séptica (SHPN).

Intelligence
Acuacultura 2019: La reunión trienal examina el estado global de la industria
La reunión trienal de Acuacultura 2019, que también celebró el 50 aniversario de la Sociedad Mundial de Acuacultura, presentó a todos los segmentos de la cadena de valor de la acuacultura durante 104 sesiones técnicas.

Health & Welfare
El microsporidio Perezia sp. y la enfermedad de algodón del camarón
Un estudio analiza muestras de camarones infectados con microsporidios en Madagascar, Mozambique y Arabia Saudita, y con signos clínicos de enfermedad de algodón del camarón.

Health & Welfare
La prueba de PCR de muestras de un solo tejido puede dar lugar a datos erróneos
Un estudio de RT-qPCR en camarón con infecciones por GAV mostró que las cargas de infección podrían diferir entre diferentes filamentos branquiales y pleópodos del mismo camarón.


