Los resultados muestran que la carne de camarones no es infecciosa después ser hervidos durante más de 1 minuto

La enfermedad de la mancha blanca (WSD), causada por el virus del síndrome de la mancha blanca (WSSV), es una de las mayores amenazas para la industria de cultivo de camarones. El WSD causa una alta mortalidad que puede alcanzar hasta el 100 por ciento en poblaciones libres de patógenos específicos (SPF) en condiciones de crecimiento en cuestión de días. El WSSV se reportó por primera vez en Taiwán en 1992. Desde entonces, se han reportado infecciones de camarones con WSSV en Japón, Corea, el sudeste asiático, el sur de Asia, el Mediterráneo, el Medio Oriente, América y Australia.
El riesgo de la introducción del WSSV se debe principalmente al movimiento internacional entre los países productores e importadores de camarones infectados, ya sea vivos o congelados, con cabeza (HO), cabeza con cáscara (HOSO) o sin cabeza con cáscara (HLSO), o como productos cocidos. Debido al riesgo de introducir inadvertidamente patógenos de camarones a través de productos básicos, algunos países, incluidos Australia, el Reino de Arabia Saudita y otros, han implementado protocolos estrictos que regulan la importación de productos de camarones y langostinos crudos. El examen para determinar la presencia y / o ausencia de algunas etiologías virales es a través de la reacción en cadena de la polimerasa (PCR). Por lo general, si el lote es positivo, el producto se destruye o se trata (es cocido).
Recientemente, camarones cocidos infectados con WSSV dieron positivo por reacción en cadena de la polimerasa (PCR). Sin embargo, no hay ningún estudio para determinar la infectividad de WSSV en camarones cocidos que dieron positivo por PCR. Se han publicado estudios que indican que los productos de camarones congelados fueron una vía para la introducción del WSSV en las Américas en 1995, pero solo hay un puñado de publicaciones revisadas por pares que destacan el riesgo de infecciosidad del WSSV del camarón cocido. Sin embargo, estos estudios restringieron sus hallazgos a la detección de WSSV por PCR y se desconoce si los camarones cocidos que contienen secuencias virales de ADN son infecciosos. El propósito de nuestro estudio, respaldado por el Laboratorio de Patología Acuícola de la Universidad de Arizona, fue evaluar la infectividad de los camarones infectados con WSSV durante la cocción.
Configuración del estudio
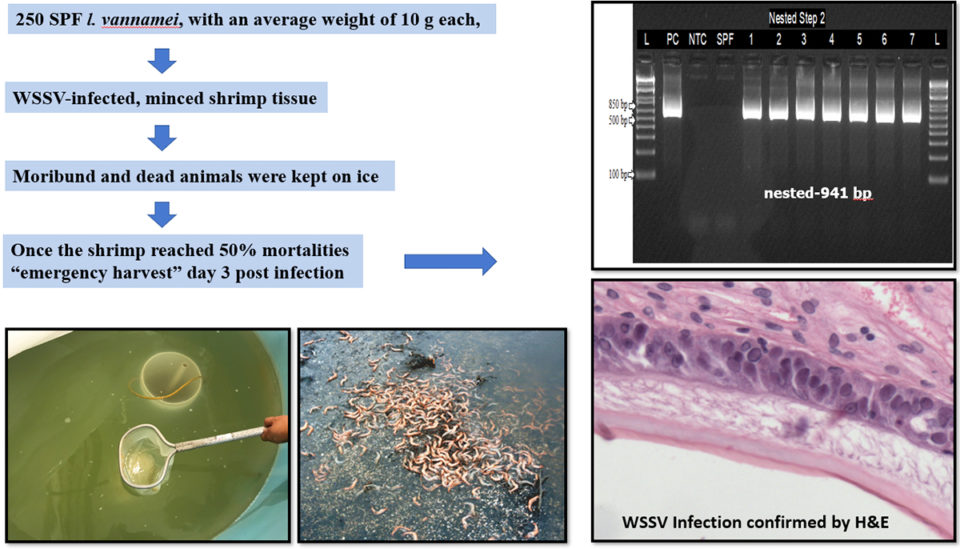
Los camarones en el estudio provenían de una instalación comercial de camarones en los Estados Unidos. Se utilizaron un total de 250 camarones blancos del Pacífico SPF (Litopenaeus vannamei) con un peso promedio de 10 gramos. Este peso de muestra representa el peso típico de los camarones en los estanques cuando se realizan cosechas de emergencia en granjas de camarones donde el WSSV es endémico y está a punto de producirse un brote de enfermedad.
Para producir camarones infectados con WSSV, se realizó una prueba de desafío de WSSV por vía oral alimentando tejido de camarones picados previamente infectados con WSSV a L. vannamei SPF. Esto se realizó al 10 por ciento del peso corporal de los animales SPF divididos en dos raciones (mañana y tarde) en un día. El agua en los tanques experimentales se mantuvo a 25 ppt de salinidad y una temperatura de 25 grados-C. Después del desafío experimental, se evaluaron las mortalidades cada hora. L. vannamei SPF fueron alimentados con tejido sano y sirvieron como control negativo.
Una vez que la mortalidad de camarones alcanzó el 50 por ciento, los animales sobrevivientes fueron retirados para simular una cosecha de emergencia y sacrificados. Muestras de branquias y pleópodos se recolectaron y conservaron para su confirmación con ensayos de PCR convencionales y en tiempo real. Cinco camarones con signos clínicos fueron fijados y preservados para el análisis histológico (Fig. 1).
La población inicial de camarones infectados se separó en seis grupos, cada uno con 40 camarones; cada grupo fue asignado a un tiempo específico de ebullición (en agua dulce) de 0, 1, 3, 5, 10 y 30 minutos. Un grupo, no infectado con WSSV, fue el control negativo. Cada grupo de 40 camarones se dividió en dos subgrupos con dos réplicas cada uno. El subgrupo 1 se hirvió utilizando los diferentes períodos de tiempo (0, 1, 3, 5, 10 y 30 minutos) antes de alimentar a L. vannamei SPF. El subgrupo 2 también se hirvió durante diferentes períodos de tiempo (0, 1, 3, 5, 10 y 30 minutos) pero se congeló (a -20 grados-C) durante 14 días antes de alimentarlo a camarones SPF (Fig. 2).
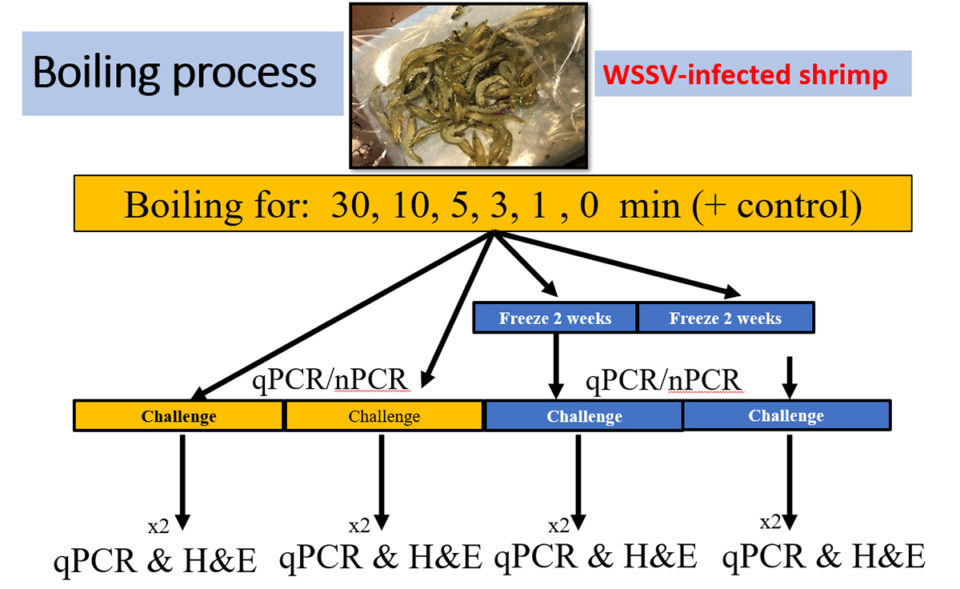
La temperatura en el tejido del camarón se midió usando un termómetro colocado dentro del músculo esquelético de la cola, y los datos de temperatura interna se recogieron antes y después del proceso de cocción. Después de la ebullición, las muestras se dejaron enfriar ligeramente y luego se recogieron y conservaron muestras de branquias y pleópodos para su posterior análisis de PCR y qPCR (la PCR cuantitativa es una versión mejorada de la PCR tradicional y se utiliza para detectar y cuantificar ácidos nucleicos para numerosos aplicaciones).
Para determinar la patogenicidad de los camarones cocidos, se realizó una prueba de desafío con una población de camarones SPF. Cada tanque de 90 litros contenía 10 juveniles (2 a 3 gramos). De cada réplica de cada período de tiempo, se muestrearon los tejidos de camarones, incluidos el estómago, las branquias y los pleópodos, y se picaron. El tejido picado se agregó al tanque en dos raciones (mañana y tarde) al 10 por ciento del peso corporal total de la población de animales SPF vivos en un día. La duración del desafío fue de 11 a 12 días. Se registraron las mortalidades diarias y se recogieron y preservaron grupos de branquias / pleópodos de camarones moribundos para ser utilizados para la detección de WSSV por qPCR y PCR. Además, los camarones moribundos se fijaron en el fijador de Davidson para sus análisis histológico.
La supervivencia acumulativa final se determinó al final del desafío. Se agruparon muestras de pleópodos de todos los camarones por tanque y se conservaron en etanol al 95 por ciento para análisis de qPCR y PCR. Se fijaron dos camarones de cada tanque en el fijador de Davidson para el análisis histológico. Los camarones congelados durante dos semanas (Grupo 2) se usaron para realizar un desafío de infección por WSSV similar usando la misma metodología descrita anteriormente.
Para información detallada sobre el diseño experimental; infección experimental de camarones, muestreo y agrupación, y ebullición de muestras; la prueba de desafío WSSV; extracción de ADN; análisis de PCR y qPCR; e histopatología, contactar al autor correspondiente.
Resultados
El tejido de camarones infectado con WSSV agregado al tanque experimental con una población de camarones de 10.5 gramos ± 1 gramo causó una alta mortalidad. El primer grupo de camarones comenzó a morir el día 2 después de la infección (d.p.i). Al 4 d.p.i., cuando la mortalidad alcanzó el 50 por ciento, los animales sobrevivientes fueron cosechados. Se confirmó que los camarones fijados con fijador de Davidson eran positivos para WSSV por PCR y H&E (la tinción de hematoxilina y eosina, o tinción de H&E, es una de las principales tinciones de tejido utilizadas en histología, el estudio de la anatomía microscópica de tejidos biológicos; ver Fig. 1 ) Treinta camarones recolectados durante el desafío fueron mantenidos en hielo, luego muestreados y confirmados positivos para WSSV por qPCR y PCR anidada (una modificación de PCR diseñada para mejorar la especificidad y sensibilidad).
Los camarones infectados con WSSV fueron expuestos a diferentes temperaturas de ebullición (0, 1, 3, 5, 10 y 30 minutos). Al final del proceso de ebullición, se tomaron muestras de branquias y pleópodos para análisis de PCR y qPCR. La Tabla 1 resume los resultados de qPCR y PCR anidada para WSSV sin congelar y congelar durante dos semanas. Muestras recogidas luego de cocinar durante tiempos diferentes dieron resultados positivos para WSSV por qPCR. En contraste, ninguna de las muestras proporcionó ninguna amplificación por PCR anidada.
Aranguren, camarón cocido, Tabla 1a
| Descripción de Tanques (Congelación por 2 semanas) | qPCR WSSV – No. positivos/No. total | Valor Ct – Me ± SD | PCR anidada para WSSV – No. positivos/No. total |
|---|
Descripción de Tanques (Congelación por 2 semanas) | qPCR WSSV – No. positivos/No. total | Valor Ct – Me ± SD | PCR anidada para WSSV – No. positivos/No. total |
|---|---|---|---|
| Control negativo | 0/4 | No detectado | ND (0/1) |
| WSSV 30 min cocción | 4/4 | 21.48±3.05 | ND (0/1) |
| WSSV 10 min cocción | 4/4 | 18.44± 0.61 | ND (0/1) |
| WSSV 5 min cocción | 4/4 | 20.54 ±3.20 | ND (0/1) |
| WSSV 3 min cocción | 4/4 | 20.01± 1.81 | ND (0/1) |
| WSSV 1 min cocción | 4/4 | 25.73± 5.00 | ND (0/1) |
| WSSV 0 min cocción (control positivo) | 4/4 | 20.35± 2.50 | Positivo (1/1) |
Aranguren, camarón cocido, Tabla 1b
| Descripción de Tanques (Congelación por 2 semanas) | qPCR WSSV – No. positivos/No. total | Valor Ct – Me ± SD | PCR anidada para WSSV – No. positivos/No. total |
|---|
Descripción de Tanques (Congelación por 2 semanas) | qPCR WSSV – No. positivos/No. total | Valor Ct – Me ± SD | PCR anidada para WSSV – No. positivos/No. total |
|---|---|---|---|
| Control negativo | 0/4 | No detectado | ND (0/1) |
| WSSV 30 min cocción | 4/4 | 21.10±2.29 | ND (0/1) |
| WSSV 10 min cocción | 4/4 | 21.22±1.30 | ND (0/1) |
| WSSV 5 min cocción | 4/4 | 22.99±2.15 | ND (0/1) |
| WSSV 3 min cocción | 4/4 | 22.16±2.06 | ND (0/1) |
| WSSV 1 min cocción | 4/4 | 20.65±1.03 | ND (0/1) |
| WSSV 0 min cocción (control positivo) | 4/4 | 21.34±2.63 | Positivo (1/1) |
En el Grupo 1 de tratamiento, el tejido de camarones infectado por WSSV y expuesto a diferentes tiempos de ebullición se usó como inóculo en una prueba de desafío per os usando camarones L. vannamei SPF. La Tabla 2 resume el porcentaje de supervivencia de camarones después de 10 d.p.i.
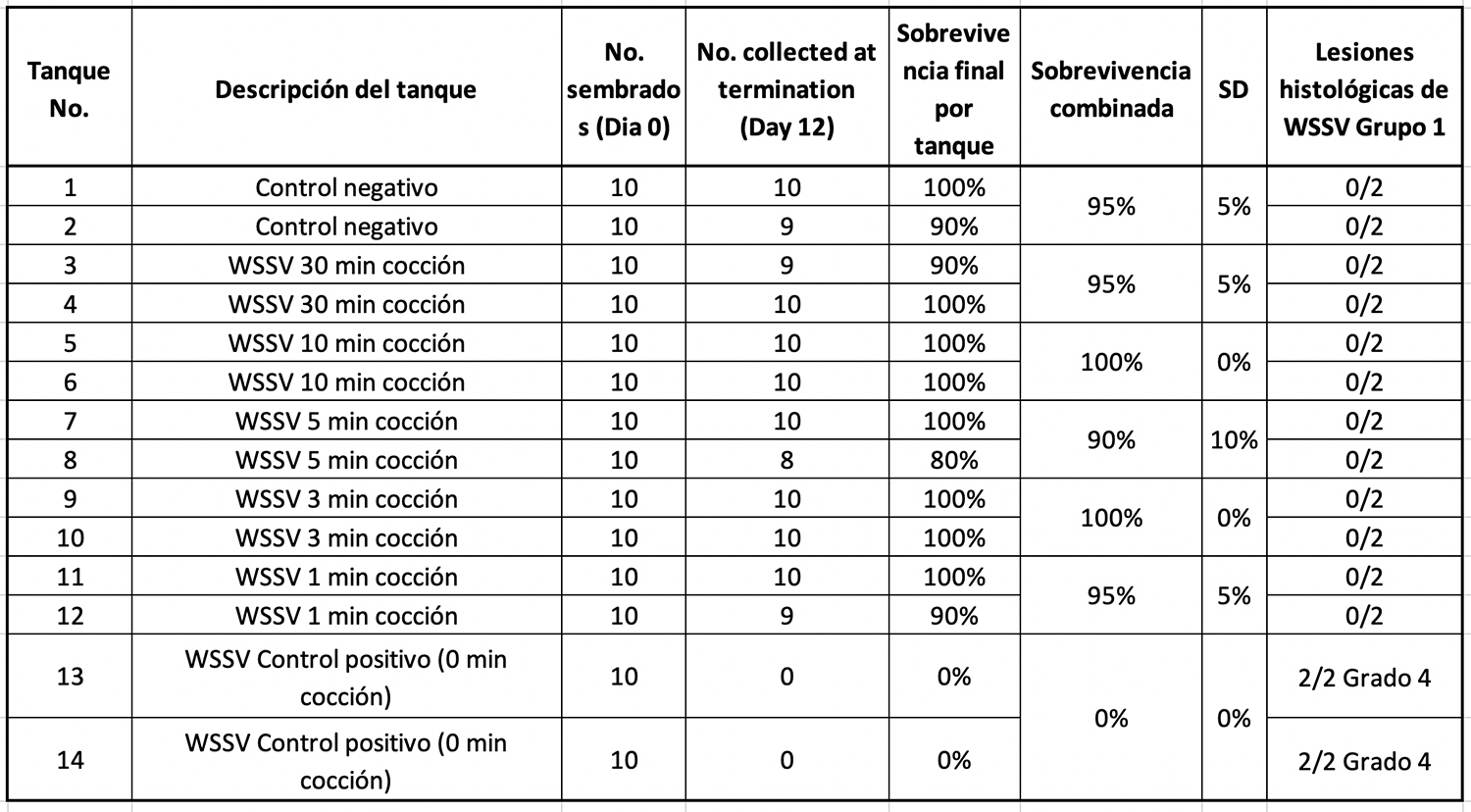
Solo se encontró una alta mortalidad en los tanques de control positivo de WSSV (cocción de 0 minutos). H&E y PCR confirmaron la presencia de WSSV en esos tanques. Se obtuvieron resultados similares cuando los camarones hervidos se congelaron durante dos semanas y luego se usaron como fuente de material infeccioso.
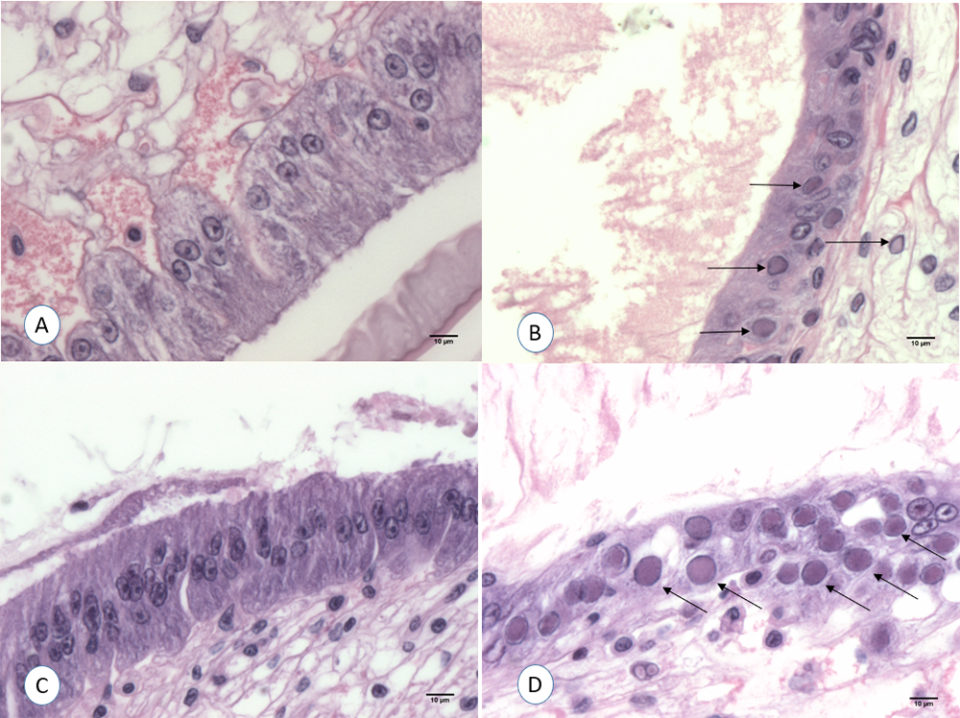
Se analizaron las muestras recolectadas para H&E de los diferentes tratamientos al final del experimento. Se encontraron cuerpos de inclusión basófilos intranucleares de WSSV dentro de los núcleos hipertrofiados en varios tejidos afectados de origen ectodérmico y mesodérmico. La Figura 3 muestra las lesiones histológicas típicas de WSSV Grado 4.0 en epitelios cuticulares del estómago del tanque de control positivo. Por el contrario, ninguno de los camarones alimentados con tejido de camarones al hervir durante diferentes tiempos (1, 3, 5, 10 y 30 minutos) mostró lesiones histológicas típicas de WSSV.
Las muestras de los juveniles infectados experimentalmente con camarones hervidos que dieron positivo por qPCR para WSSV fueron negativos en todos los casos (Tabla 3).
Aranguren, camarón cocido, Tabla 3
| Descripción de tanques | Camarones infectados con WSSV cocidos en diferentes momentos | qPCR WSSV – No. positivos/No. total | Valor Ct – Media ± SD |
|---|
Descripción de tanques | Camarones infectados con WSSV cocidos en diferentes momentos | qPCR WSSV – No. positivos/No. total | Valor Ct – Media ± SD |
|---|---|---|---|
| SPF camarones desafío con camarones SPF | Control negativo | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 30 minutos | Desafío SPF con camarones WSSV con 30 min cocción | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 10 minutos | WSSV 10 min cocción | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 5 minutos | WSSV 5 min cocción | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 3 minutos | WSSV 3 min cocción | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 1 minuto | WSSV 1 min cocción | 0/4 | ND |
| Desafío de camarones SPF con camarones infectados con WSSV cocinados durante 0 minutos | Control positivo de WSSV (0 min. de cocción) | 4/4 | 21.57±1.73 |
Discusión
Nuestros resultados demostraron que los camarones infectados con WSSV expuestos a temperatura de ebullición durante tiempos que variaron de 1 a 30 minutos no fueron infecciosos. Los datos de qPCR confirmaron la presencia de ADN de WSSV en todas las muestras expuestas a diferentes tiempos de ebullición, y no se encontraron diferencias significativas de los valores de Ct (umbral de ciclo, número de ciclos cuando se puede detectar la fluorescencia de un producto de PCR por encima de la señal de fondo) entre los diferentes tiempos de ebullición (P <0.05). Sin embargo, ninguna de las muestras proporcionó una amplificación exitosa de WSSV por PCR anidado.
Los resultados de qPCR mostraron resultados positivos, lo que contradecía los resultados negativos con la PCR anidada. Es probable que el ADN de WSSV aislado de camarones hervidos haya sufrido un daño significativo que resulta en una calidad reducida y fragmentada que los aislados de una muestra recién cosechada. El tamaño esperado del amplicón de la etapa 1 de la PCR anidada (un fragmento de ADN que es el producto de los eventos de amplificación o replicación) es de 1,447 pb, y el amplicón interno de la etapa 2 es de 941 pb. La ausencia de los amplicones de 1,447 pb y 941 pb en los resultados de PCR anidados muestra que el ADN del WSSV se ha degradado en fragmentos más pequeños y, por lo tanto, ha perdido la infectividad. En contraste, el tamaño del amplicón qPCR es de solo 69 pb, un amplicón significativamente más pequeño que el de PCR anidada. Como resultado, incluso cuando el ADN del WSSV se fragmentó al hervir, aún se pueden amplificar pequeños amplicones y se obtuvieron resultados positivos mediante qPCR.
Para confirmar la infectividad de L. vannamei infectado con WSSV que dio positivo solo por qPCR, se realizó una prueba de desafío experimental con camarones SPF. La supervivencia final fue alta en todos los tanques alimentados con el tejido picado positivo a WSSV por qPCR expuesto a la temperatura de ebullición de 1 a 30 minutos. Las mortalidades se obtuvieron solo en camarones expuestos al tejido picado de control positivo (0 minutos de ebullición). Los camarones sobrevivientes al final del desafío de todos los tanques fueron analizados por H&E y qPCR. Se encontraron cuerpos de inclusión de WSSV en el epitelio cuticular y tejidos conectivos en camarones que habían sido alimentados con el tejido picado de control positivo. En contraste, la histología de camarones desafiados con tejido positivo de WSSV hervido a 1, 3, 5, 10 y 30 minutos no mostró ninguna lesión histológica patognomónica de infección por WSSV. Las Figuras 3A y 3C muestran la sección histológica del estómago de un camarón expuesto al tejido positivo de WSSV hervido durante 1 minuto. El análisis de qPCR se realizó a partir de dos grupos de cada tanque. Los únicos resultados positivos de qPCR se encontraron en camarones desafiados con tejido positivo de WSSV (control positivo).
Los resultados de nuestro estudio indican que cocinar los camarones podría reducir la propagación del WSSV de las rutas mundiales de exportación / importación de camarones de cultivo. Creemos que sería de interés para la industria del camarón y otros utilizar nuestro enfoque para probar otros patógenos microbianos que infectan al camarón de cultivo, incluidos otros virus, así como bacterias y hongos.
Perspectivas
En nuestro estudio, los camarones infectados con WSSV se cocinaron a temperatura de ebullición durante diferentes tiempos, incluidos 0, 1, 3, 5, 10 y 30 minutos. Después de la exposición a la temperatura de ebullición, los camarones infectados con WSSV se alimentaron a camarones blancos del Pacífico SPF (L. vannamei). Los resultados mostraron que los camarones desafiados experimentalmente del tratamiento de 0 minutos (control positivo) se infectaron con WSSV. Sin embargo, los camarones desafiados experimentalmente que fueron alimentados con tejidos hervidos durante 1, 3, 5, 10 y 30 minutos no se infectaron con WSSV.
Los datos de mortalidad resultantes mostraron que solo el tratamiento de control positivo (0 minutos) mostró una mortalidad alta, mientras que no se observó mortalidad en ninguno de los otros tratamientos. Estos hallazgos sugieren que cocinar los camarones a temperatura de ebullición durante al menos 1 minuto podría prevenir cualquier posible propagación del WSSV desde países endémicos a otras áreas geográficas donde aún no se ha reportado el WSSV. Se debe utilizar un método anidado para la detección de WSSV en lugar del método qPCR al evaluar la infectividad de los camarones cocidos.
Referencias disponibles del autor correspondiente.
Ahora que Ud. ha terminado de leer el artículo ...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria de acuícola global y compartir nuestra vasta red de conocimiento en expansión de los contribuyentes cada semana.
Al convertirse en miembro de la Global Aquaculture Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de los beneficios, recursos y eventos de los miembros (la Academia, The Advocate, GAA Films, GOAL, MyGAA) pueda continuar. Una membresía individual cuesta solo $ 50 al año.
Authors
-

Luis Fernando Aranguren Caro, Ph.D.
Corresponding author
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Hung N. Mai, Ph.D.
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -
Linda Nunan, MSc
School of Animal and Comparative Biomedical Sciences
University of Arizona, 1117 E. Lowell Street
Tucson, Arizona 85721 USA -
Joshua Lin, BSc
School of Animal and Comparative Biomedical Sciences
University of Arizona
1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Brenda Noble, BSc
School of Animal and Comparative Biomedical Sciences
University of Arizona
1117 E. Lowell Street
Tucson, Arizona 85721 USA -

Arun K. Dhar, Ph.D.
School of Animal and Comparative Biomedical Sciences
University of Arizona
1117 E. Lowell Street
Tucson, Arizona 85721 USA
Tagged With
Related Posts

Health & Welfare
Camarón sin ablación de Seajoy responde a preocupación emergente de bienestar
La remoción del tallo o pedúnculo ocular de camarones hembras reproductoras ha ayudado en el crecimiento explosivo de la acuacultura a escala comercial. Un compromiso de un productor de camarones de América Central ha demostrado que la producción de camarones sin ablación puede aliviar las preocupaciones de bienestar animal sin la temida caída en la producción.

Innovation & Investment
Productor de Texas está dando una carga a la producción de camarón en RAS
El productor de camarón en RAS de los EE.UU., Natural Shrimp, utiliza la electrocoagulación para eliminar y controlar las bacterias, el amoníaco y otros contaminantes que pueden dificultar la producción.

Health & Welfare
Construyendo un mejor pre-criadero de camarones, parte 1
Los sistemas de pre-criadero de camarones ofrecen una oportunidad importante para aumentar los beneficios. Los pre-criaderos adecuadamente diseñados y operados son instalaciones altamente bioseguras para criar postlarvas a densidades muy altas. El objetivo es producir juveniles fuertes, sanos y uniformes con un potencial significativo de crecimiento compensatorio después de su transferencia para el crecimiento final en estanques.

Health & Welfare
Desafiando postlarvas de camarón blanco del Pacífico con AHPND
Los resultados del estudio indican que P. vannamei desafiado con AHPND en biofloc tuvo mayores tasas de supervivencia que los camarones desafiados en agua clara.


